Выпуск № 3 — 03/04/2020 Биология
Мембраностабилизирующее действие противовирусного средства
Введение
В связи с развитием неблагоприятной ситуации, связанной с распространением коронавируса 2019-nCoV, актуальным в настоящее время является разработка эффективного лекарственного препарата для предупреждения развития вирусной пневмонии, которая является главным осложнением гриппа и других вирусных инфекций (ОРВИ, включая коронавирусы).
Научно-исследовательский центр «Парк активных молекул» г. Обнинск разрабатывает и предлагает оригинальное противогриппозное средство с новой химической структурой и отличным механизмом действия. В качестве нового противогриппозного средства предлагается химическое соединение производное индола. Разрабатываемое средство может применяться для предупреждения развития пневмонии, вызванной вирусами гриппа и других вирусных инфекций (ОРВИ, включая коронавирусы).
В ранее проведенных исследованиях показано, что для химического ряда 5-оксииндолов, к которым относится разрабатываемое средство, на клеточных культурах установлена высокая эффективность по отношению к различным серотипам вирусов гриппа, в том числе к коронавирусам (в том числе возбудителю SARS) [1]. Кроме вирусспецифической активности у них выявлено общее мембраностабилизирующее действие, что также помогает сохранить целостность и функциональность альвеол легких при вирусных и бактериальных инфекциях. Мембраностабилизирующий эффект является характерным для всего класса соединений и проявляется ещё и при действии радиационного облучения и химиопрепаратов у экспериментальных животных [2]. При этом до сих пор остаются вопросы механизма мембраностабилизирующего действия для всего класса соединений 5-оксииндолов, в том числе разрабатываемого средства.
Известно, что клеточная мембрана - это динамическая структура, которая непрерывно изменяет свою форму. Важнейшие клеточные процессы, такие как экзо - и эндоцитоз, внутриклеточный везикулярный транспорт, связаны с топологическими перестройками мембран, слиянием и делением, требующими локального нарушения бислойной структуры. Эти процессы сопряжены с формированием сильно искривленных мембранных поверхностей, определенная конфигурация и липидный состав которых поддерживается за счет специфических липид-белковых взаимодействий. Аналогичные процессы локального изменения морфологии мембран реализуются и на различных стадиях инфицирования клетки вирусом гриппа, будь то поглощение вириона в процессе клеточного эндоцитоза, слияние вирусной и эндосомальной мембраны, предшествующее выходу генетического материала вируса в цитоплазму зараженной клетки, или отпочковывание дочерних вирусных частиц с поверхности ее плазматической мембраны. Понятно, что затраты энергии, необходимые для осуществления подобных топологических перестроек мембранных структур клетки, будут определяться механическими свойствами мембраны как сплошной среды. Необходимый формализм для такого описания был разработан в работах Хельфрика [3] и дополнен Хаммом и Козловым [4]. В этих работах было предложено рассматривать липидный бислой клетки как двумерный жидкий кристалл и использовать для описания механических свойств мембран теорию упругости жидких кристаллов. В рамках этого подхода средняя ориентация липидных молекул описывается векторным полем единичных векторов, называемых директором, n. Поле директоров задается на некоторой поверхности, проходящей внутри липидного монослоя. Форма поверхности характеризуется векторным полем единичных нормалей к ней, N. В механике мембран, как правило, рассматриваются три основные независимые деформации: поперечного изгиба, наклона и латерального растяжения/сжатия. Деформация поперечного изгиба соответствует появлению угла между директорами в близких точках разделяющей поверхности, и количественно характеризуется дивергенцией директора, div(n). Деформация наклона соответствует отклонению директора от нормали и количественно характеризуется вектором наклона t = n - N. Латеральное растяжение/сжатие характеризуется относительным изменением площади разделяющей поверхности монослоя, (a - a0)/a0, где a - текущая площадь, приходящаяся на липид на разделяющей поверхности, a0 - исходная площадь. Часть свободной энергии, связанной с деформациями, представляется разложением в ряд Тейлора по этим деформационным модам относительно спонтанного состояния в предположении малости деформаций. Кривизна монослоя в спонтанном состоянии может быть отличной от нуля. Эта кривизна называется спонтанной. Спонтанная кривизна определяется липидным составом мембраны. Считается, что спонтанная кривизна многокомпонентного монослоя равна средневзвешенной по концентрациям спонтанной кривизне отдельных компонентов. Таким образом, деформационная часть свободной энергии оказывается связана с «химическим» вкладом в силу зависимости спонтанной кривизны от концентраций липидных компонентов. Каждая из деформаций характеризуется своим модулем, т.е. энергией, которую необходимо затратить для ее реализации. Эксперименты в различных модельных липидных системах показали, что наибольший модуль характерен для деформации латерального растяжения/сжатия мембраны, и поэтому подобная деформация практически не реализуется в процессах клеточного морфогенеза, а наибольшее влияние на процессы топологических перестроек мембраны оказывает деформация поперечного изгиба [5].
В связи с этим целью настоящей работы было изучение воздействия производного индолов на изгибную жесткость мембраны в зависимости от наличия в ней ключевых компонентов клеточных мембран, а именно: холестерина, заряженных липидов, а также при различной степени насыщенности углеводородных цепей молекул липидов.
1 Модель липидной нанотрубки и ее применение для анализа механических свойств мембран
Для проведения этих исследований была выбрана модель липидной нанотрубки (НТ), впервые предложенная сотрудниками лаборатории биоэлектрохимии ИФХЭ РАН, и хорошо зарекомендовавшая себя при исследованиях процесса морфогенеза липидных мембран в процессе клеточного эндоцитоза [6, 7].
Для исследования влияния производного индолов на механические свойства мембран использовалась экспериментальная установка, состоящая из универсального генератора PAR-175 (Princeton Applied Research, США), пэтч-кламп усилителя EPC-8 (HEKA Elektronik, Германия), четырехполюсного фильтра F-900 (Frequency Devices, США) и осциллографа OS-1420 (GOULD, Англия). Положение пипетки относительно БЛМ варьировалось с помощью контроллеров движения Newport Motion Controller (Model 860-C2) и заранее откалиброванного микроконтроллера движения Model ESA-CSA (Newport, США) (пьезоконтроллер, позволяющий менять вертикальное положение пипетки с точностью до 0,1 мкм.).
Формирование модельной бислойной липидной мембраны (БЛМ) осуществлялось методу Мюллера-Рудина [8] на отверстиях в медной решетке (EMS, США) диаметром ~100 мкм, расположенной в объеме чашки Петри. Отверстия решетки обрабатывались раствором фосфолипидов (Avanti Polar Lipids Inc., США) в смеси октан/декан 1/1 (Sigma, США) в концентрации 10 мг/мл и высушивались в атмосфере. После этого чашка Петри заполнялась раствором электролита (10 мМ KCl, 1 мМ Hepes, 0,1 мМ EDTA, pH = 7,0; 50 мМ KCl, 5 мМ Hepes, 0,5 мМEDTA, pH = 7,0 или 100 мМ KCl, 10 мМ HEPES, pH 7,0), и на отверстия в решетке кисточкой наносилась капля раствора фосфолипидов в сквалане (Sigma, США) в концентрации 10 мг/мл, которая в течение нескольких минут спонтанно образовывала БЛМ. При этом растворитель и лишний липид уходили в объёмную фазу, окружающую БЛМ, то есть в мениск. В экспериментах использовались следующие растворы липидов: 1,2-диолеоил-sn-глицеро-3-фосфатидилхолин (DOPC), 10 мг/мл 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолин (POPC), 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE), 1,2-диолеоил-sn-глицеро-3-фосфатидилсерин (DOPS) и холестерин (Cholesterol) (Avanti Polar Lipids Inc., США) в хлороформе, концентрацией 10 мг/мл, в соотношениях, указанных в тексте.
После формирования БЛМ на хлорсеребряные электроды посредством пэтч-кламп усилителя подавался пилообразный сигнал с генератора, и регистрировался емкостной ток мембраны в режиме фиксации потенциала. С помощью микроманипулятора к мембране подводили пэтч-пипетку, так что между кончиком микропипетки и мембраной формировался плотный контакт (сопротивление контакта 1-10 ГОм), что было видно по резкому уменьшению емкостного тока. Для разрушения мембраны под пипеткой скачком менялось гидростатическое давление, что приводило к появлению тока проводимости. После этого, отводя пипетку от плоской мембраны, вытягивали мембранную трубку. Электрическая проводимость трубки измерялась в режиме фиксации разности потенциалов между измерительным электродом внутри пэтч-пипетки и земляным электродом во внешнем объеме электролита с помощью усилителя тока. Значения используемых потенциалов указаны в тексте.
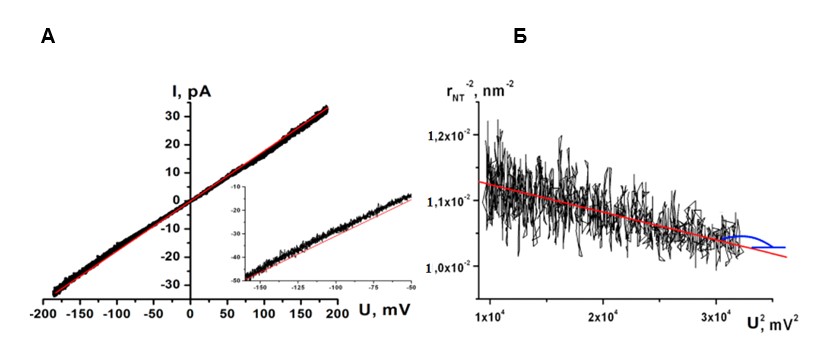
Плавное изменение длины трубки осуществлялось с помощью пьезоконтроллера. Полученные данные - ток через трубку, преобразованный пэтч-кламп усилителем в напряжение (коэффициенты усиления от 1мВ/пА до 30мВ/пА), значения приложенного к концам трубки электрического напряжения и данные с индикатора пьезоконтроллера - записывались на жесткий диск компьютера после предварительной оцифровки с помощью АЦП L-305/L-1210 (L-card, Россия). Частота опроса 1 кГц. Перед вводом в компьютер сигналы пропускались через фильтр низких частот (F‑900); частота среза 0,5 кГц. Показания пьезоконтроллера пересчитывались в значения вертикального смещения пипетки с помощью калибровочной кривой. При переходе МТ в НТ ток проводимости резко падал до нуля (Рисунок 1, кривая 1), после чего движение пипетки останавливалось. Далее, усиливая сигнал от тока проводимости в 10-30 раз и приближая пьезоконтроллером пипетку к мембране, снимали изменения тока проводимости через НТ, и если наблюдалось увеличение тока, то можно было сказать о наличии НТ между пипеткой и мембраной. После чего снимали зависимость силы тока проводимости от положения микропипетки.
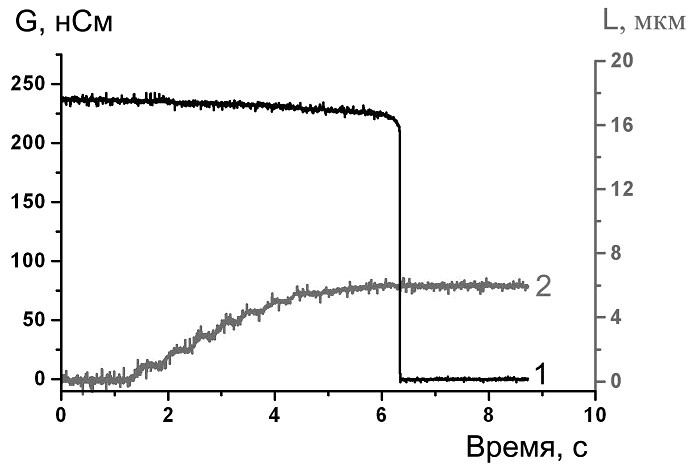
Особенности формирования НТ позволяют нам следить за изменением проводимости вытягиваемой трубки в зависимости от её длины (Рисунок 2, В). Измеряемая в ходе эксперимента проводимость включает в себя проводимость НТ и проводимость утечки в месте контакта мембраны с пэтч-пипеткой. Считая, что форма НТ слабо отличается от цилиндрической, и, предполагая, что проводимость утечки постоянна (при движении пипетки меняется только длина L НТ), электрическое сопротивление RНТ должно линейно зависеть от изменения длины ΔLНТ. Действительно, линейная функция дает хорошую аппроксимацию зависимости R(L) (Рисунок 2, Г). Таким образом, так как:
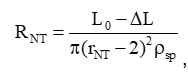 ,
,
где ρsp - удельное сопротивление электролита, то может быть вычислена как длина L НТ, так и её радиус rNT.
В случае, если НТ содержит заряженные липиды, необходимо учитывать тот факт, что концентрация ионов электролита внутри НТ выше, чем снаружи [10].
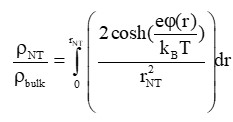 ,
,
где ρNT/ρulk - удельная проводимость электролита внутри НТ/снаружи НТ, φ® - распределение потенциала внутри НТ.
Равновесный радиус такой НТ определяется как:
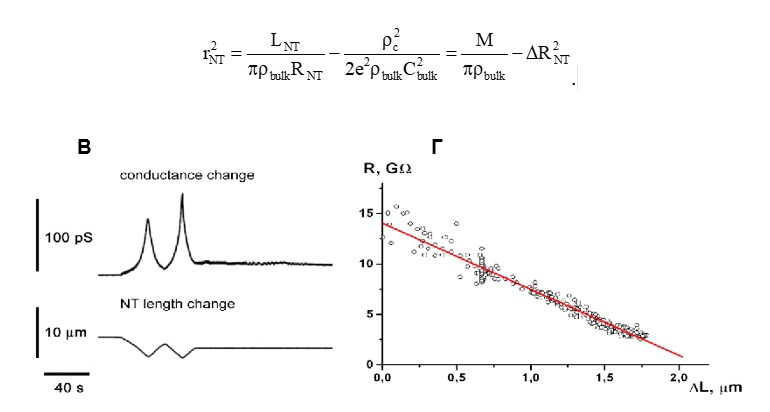
Г - аппроксимация экспериментальной зависимости R от L линейной функции.
Для измерения механических параметров был использован метод [9]. Суть метода заключается в анализе зависимости измеряемого радиуса НТ от величины, приложенной к ее концам разности потенциалов. Дело в том, что равновесный радиус НТ определяется корнем отношения модуля изгиба мембраны НТ к латеральному натяжению БЛМ, а согласно уравнению электрокапиллярности Липпмана, латеральное натяжение уменьшается при появлении трансмембранного напряжения. Таким образом, в результате падения электрического потенциала вдоль НТ происходит изменение трансмембранного потенциала на стенке НТ от приложенного значения на одном конце до 0 на противоположном. Это приводит к тому, что форма НТ отклоняется от цилиндрической. Однако, как показали наши теоретические расчеты, электрическое сопротивление НТ сохраняет линейную зависимость от ее длины. Таким образом, измеряемый радиус НТ соответствует радиусу некого эффективного цилиндра, который имеет туже проводимость и длину, что и НТ. Причем величина эффективного радиуса НТ связана с механическими параметрами и величиной приложенной к концам НТ разности потенциалов следующим выражением:
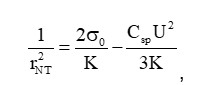
где K - модуль изгиба мембраны, σ0 - латеральное натяжение БЛМ, Csp - удельная электрическая емкость БЛМ, U - напряжение, приложенное к концам НТ.
Следовательно, из линеаризации зависимости обратного квадрата радиуса НТ от квадрата приложенного напряжения можно найти и модуль изгиба мембраны, и латеральное натяжение БЛМ (Рисунок 3).
2 Результаты исследований взаимодействия производного индолов с липидными нанотрубками
Для исследования влияния исследуемого соединения на механику липидного матрикса клеточных мембран с использованием модели липидных нанотрубок был выбран липидный состав, аналогичный описанному для клеток почки собаки Майдин-Дэрби (MDCK) (основные компоненты - фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и холестерин), на которых проводилось подробное изучение клеточного и вирусного липидома, их общих черт и отличий [10]. Кроме того, были использованы липиды как с насыщенными, так и с ненасыщенными липидными хвостами, что характерно для клеточных мембран. В ряде экспериментов при оценке влияния заряженных липидов на процесс взаимодействия исследуемого соединения с липидными мембранами заряженные компоненты мембраны были удалены и заменены на нейтральный диолеоилфосфатидилхолин (DOPC). Аналогично в случае экспериментов с различным количеством холестерина также отходили от клеточного состава.
Добавление исследуемого соединения в систему осуществлялась тремя различными способами: из раствора в деионизированной воде концентрацией 0,1 мг/мл, из раствора в 96% этиловом спирте концентрацией 1 мг/мл, либо путем добавления раствора исследуемого соединения в хлороформе концентрацией 1 мг/мл непосредственно к липидной смеси на стадии формирования БЛМ.
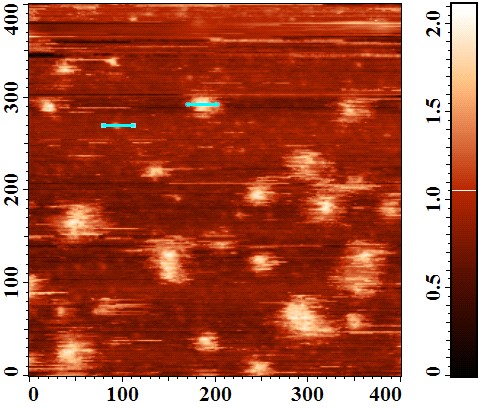
В первом случае (водный раствор концентрацией 0,1 мг/мл) исследуемое соединение не растворялось полностью: в воде оставалась взвесь, которая не исчезала в течение длительного времени (две недели). Поэтому для дальнейшей работы этот раствор был выдержан в ультразвуковой ванне и отфильтрован через поры диаметром 100 нм. Полученный раствор был исследован методом атомной силовой микроскопии (АСМ) на подложке из слюды. Для этого он наносился на слюду (диаметр подложки составлял 1,5 см) в объеме около 200 мкл и инкубировался в течение 15 минут при комнатной температуре, далее каплю раствора высушивали потоком аргона. Полученный образец сканировался в резонансном режиме работы прибора (tapping mode).
Из полученного изображения (Рисунок 4) видно, что на поверхности слюды представлены сферические частицы вещества, размеры которых сильно варьируются: высоты частиц составляет от 0,6 до 1,4 нм, диаметр частиц лежит в диапазоне 20-80 нм. Полученные данные свидетельствуют о том, что в воде исследуемое соединение представлено в основном в виде агломератов.
Как в хлороформе, так и в 96%-м растворе этилового спирта исследуемое соединение в концентрации 1 мг/мл растворялось полностью. Изображения, полученные методом АСМ, показали, что в этих случаях исследуемое соединение представлено частицами, высоты которых лежат в диапазоне от 0,2 до 0,9 нм, а диаметр составляет от 12 до 20 нм (Рисунок 5).

Однако раствор исследуемого соединения в этаноле через две недели приобрел желтоватый окрас, интенсивность которого зависела от ее концентрации. Это может свидетельствовать о переходе исследуемого соединения из формы гидрохлорида в форму основания.
Было проведено исследование взаимодействия спиртового раствора исследуемого соединения с мембраной следующего липидного состава: DOPC/DOPE/POPC/Cholesterol = 49/13/13/25 mol%. (DOPC - диолеоилфосфатидилхолин; DOPE - диолеоилфосфатидилэтаноламин; POPC - пальмитоилолеоилфосфатидилолин)
Было показано, что добавление спиртового раствора исследуемого соединения в систему до конечной концентрации в 1 мкг/мл (буфер 10 мМ KCl, 1 мМ Hepes, 0,1 мМ EDTA, pH = 7,0) статистически достоверно уменьшает изгибный модуль мембраны в два раза. Дальнейшее увеличение концентрации исследуемого соединения в растворе до 2 мкг/мл не приводило к статистически значимому изменению модуля изгиба. Было выявлено, что латеральное натяжение мембраны не зависело от наличия исследуемого соединения в растворе. В контрольных экспериментах было показано, что при добавлении этилового спирта к мембране (максимальное значение объемной доли спирта в растворе достигало 0,2%, что соответствовало аналогичной добавке спиртового раствора исследуемого соединения) изгибный модуль мембраны не изменялся. Однако, тот факт, что в спиртовом растворе исследуемого соединения, возможно, переходит из формы гидрохлорида в форму основания, не позволяет сделать определенный вывод о влиянии исходного исследуемого соединения на мембрану при добавлении его в спиртовом растворе.
Было проведено исследование свойств мембраны при наличии в ней исследуемого соединения. Для этого в раствор липидов DOPC/DOPE/POPC/Cholesterol, растворенных в хлороформе, было добавлено исследуемое соединение, также растворенный в хлороформе (концентрация 1 мг/мл). Эксперименты проводились для следующего соотношения компонентов: DOPC/DOPE/POPC/Cholesterol/ФС = 49-X/13/13/25/X mol%, где X принимает значения: 0,02; 0,1; 0,5 mol%. Полученные значения модуля изгиба мембраны не зависели от исходной концентрации исследуемого соединения в смеси, и составили (0,3 ± 0,1) × 10-19 Дж. Значение модуля изгиба в отсутствии составили (0,9 ± 0,1) × 10-19, то есть ФС, изначально добавленный в состав мембраны, понижает ее модуль изгиба в 3 раза. Причем, факт отсутствия зависимости модуля изгиба от концентрации исследуемого соединения в мембране, скорее всего, говорит о том, что уже при концентрации 0,02 mol% достигается практически предельно возможная ее концентрация в бислойной липидной мембране.
Было проведено исследование взаимодействия водного раствора исследуемого соединения, приготовленного, как описано выше, с мембраной в зависимости от концентрации холестерина в ней. Эксперименты проводились с буферным раствором: 50 мМ KCl, 5 мМ Hepes, 0,5 мМEDTA, pH = 7,0 липидным составом DOPC/DOPE/POPC/Cholesterol = 49/13/13/25 mol%иDOPC/DOPE/POPC/Cholesterol = 34/13/13/40 mol%. При 25 mol% холестерина в отсутствии исследуемого соединения значение модуля изгиба составляет с, после добавления исследуемого соединения модуль уменьшился до значения (0,4 ± 0,1) × 10-19 Дж, что в пределах погрешности измерений соответствует результатам, полученным при его внесении непосредственно в состав мембраны из раствора в хлороформе (падение модуля изгиба в 2-3 раза). В случае 40 mol% холестерина, что соответствует его уровню в составе липидной оболочки вируса гриппа [11], в отсутствии исследуемого соединения значение модуля изгиба совпадает со значением для мембраны при 25 mol% холестерина (0,9 ± 0,1) × 10-19 Дж. После добавления водного раствора исследуемого соединения значение данного модуля составило (0,6 ± 0,1) × 10-19 Дж, то есть ее эффект на изгибную жесткость мембраны уменьшился пропорционально концентрации холестерина в мембране.
При введении в систему заряженных липидов (фосфатидилсерин) до уровня, соответствующего среднему содержанию данных липидов в клеточных мембранах (состав DOPC/DOPE/POPC/Cholesterol/DOPS = 34/13/13/25/15 mol%) (DOPS - диолеоилфосфатидилсерин), эффект исследуемого соединения на уменьшение изгибной жесткости мембраны становился наиболее выраженным: наблюдалось падение модуля изгиба от (0,88 ± 0,14) × 10-19 Дж до (0,22 ± 0,10) × 10-19 Дж.
Заключение
Таким образом, проведено исследование влияния исследуемого соединения на механические свойства липидных мембран на модели липидных нанотрубок. Были рассмотрены три возможных варианта добавления исследуемого соединения в систему: в виде отфильтрованного водного раствора, в виде раствора в спирте и путем непосредственного введения в состав мембраны из раствора в хлороформе. Во всех этих случаях наблюдали, что при добавлении исследуемого соединения к липидной мембране изгибная жесткость последней уменьшалась. Однако в случае спиртового раствора происходил переход исследуемого соединения из формы гидрохлорида в форму основания, в связи с чем для дальнейших исследований эти растворы не использовались. Факт совпадения результатов для случая добавления исследуемого соединения в виде водного раствора в омывающий мембрану буфер с результатами для непосредственного ее встраивания в состав БЛМ показывают, что во всех случаях наблюдается встраивание исследуемого соединения в мембрану, приводящее к 3-х кратному уменьшению изгибной жесткости последней. Причем предельная концентрация исследуемого соединения в составе липидного бислоя не превышает 0,02 мольных процента. Так как низкая изгибная жесткость мембран, как было сказано выше, упрощает локальные топологические перестройки мембран клеток [9, 10], то исследуемое соединение потенциально может ускорять процессы жизнедеятельности клетки, синаптической передачи, фагоцитоза и т.п. Необходимо отметить, что максимальный эффект падения изгибной жесткости наблюдался при наличии в составе мембраны заряженных липидов, т.е. именно в том случае, когда липидный состав нанотрубок максимально близко отображал состав клеточных мембран.
Эксперименты с различным содержанием холестерина в составе липидной мембраны показали, что данный компонент клеточных мембран, по всей видимости, препятствует встраиванию исследуемого соединения в липидный бислой, т.е. его внедрение в липидную мембрану вириона, обогащенную холестерином, представляется более затруднительным, чем в клеточную мембрану. Однако это утверждение требует дополнительной проверки, которая будет проведена на следующем этапе исследований.
Таким образом, у производного индолов обнаружено не только выраженное вирусоспецифическое действие, но и свойства изменять гибкость и увеличивать устойчивость мембран эпителиальных клеток бронхолегочной системы, способствовать созданию специфической иммунной защиты. Результаты проведенных исследований позволяют рассматривать исследуемое соединение к применению до- и во время вирусной эпидемии, в том числе для предупреждения развития вирусной пневмонии, которая является главным осложнением гриппа и других вирусных инфекций (ОРВИ, включая коронавирусы).
Выражаем огромную благодарность и признательность заведующему лаборатории биоэлектрохимии и его сотрудникам Института физической химии и электрохимии им. А.Н. Фрумкина РАН профессору, к.ф.-м.н., доценту О.В. Батищеву за помощь в проведении исследований мембраностабилизирующего действия производного индолов.
Авторский коллектив (ООО «Научно-исследовательский центр «Парк активных молекул», г.Обнинск):
- Еримбетов Кенес Тагаевич, д.б.н.
- Гончарова Анна Яковлевна, к.б.н.
- Бондаренко Екатерина Валерьевна, к.б.н.
- Розиев Рахимджан Ахметджанович, к.м.н.
- Земляной Руслан Александрович, аспирант
Список использованных источников
- Дондурей Е.А., Осидак Л.В., Головачева Е.Г., Голованова А.К., Гладченко Л.Н., Костицина Е.К. Арбидол в комплексной терапии сочетанного поражения респираторного и желудочно-кишечного трактов у детей // Детские инфекции. - 2007. - № 2. - С.39-44.
- Мирошниченко А.Г. Эффективность арбидола в коррекции нефротоксического действия противоопухолевых химиотерапевтических средств (экспериментальное исследование) // Автореферат диссертации на соискание ученой степени кандидата медицинских наук. - 2010. - 21 с.
- Helfrich W. Elastic properties of lipid bilayers: theory and possible experiments // Z. Naturforsch - 1973 - 28 - P. 693-703.
- Hamm M. Elastic energy of tilt and bending of fluid membranes / Hamm M., Kozlov M.M. // Eur. Phys. J. - 2000 - P. 323-335.
- Галимзянов Т.Р. Линейное натяжение и структура границы рафта, рассчитанные с учетом деформаций изгиба, наклона и растяжения/сжатия /Т.Р. Галимзянов, Р.Ю. Молотковский, С.А. Акимов//Биол. Мембраны - 2011- 28(5) - P.415-422.
- Bashkirov P.V. GTPase cycle of dynamin is coupled to membrane squeeze and release, leading to spontaneous fission / P.V. Bashkirov, S.A. Akimov, A.I. Evseev, S.L. Schmid, J.Zimmerberg, V.A. Frolov // Cell - 2008 - 135(7) - P. 1276-1286.
- Shnyrova A.V. Geometric catalysis of membrane fission driven by flexible dynamin rings. / P.V. Bashkirov, S.A. Akimov, T.J. Pucadyil, J. Zimmerberg, S.L. Schmid, V.A. Frolov // Science - 2013- 339(6126) - P. 1433-1436.
- Mueller P. Methods for the formation of single bimolecular lipid membranes in aqueous solution / P. Mueller, D.O. Rudin, H.T. Tien, W.C. Wescott // J. Phys. Chem. - 1963 - 67 - P. 534-535.
- Башкиров П.В. Мембранные нанотрубки в электрическом поле как система для измерения механических параметров липидного бислоя // Биол. Мембраны - 2007 - 24(2) - P. 183-192.
- Gerl M.J., Quantitative analysis of the lipidomes of the influenza virus envelope and MDCK cell apical membrane / M.J. Gerl, J.L. Sampaio, S. Urban, L. Kalvodova, J.-M. Verbavatz, B. Binnington, D. Lindemann, C.A. Lingwood, A. Shevchenko, C. Schroeder, K. Simons //J. Cell Biol. - 2012 - 196(2) P. 213-221.
- Campelo F. Helfrich model of membrane bending: from Gibbs theory of liquid interfaces to membranes as thick anisotropic elastic layers / F. Campelo, C. Arnarez, S.J. Marrink, M.M. Kozlov // Adv. Colloid Interface Sci. - 2014 -208 P. 25-33.

