Выпуск № 7 — 15/11/2023 Диагностика
Оценка уровня аутоантител к онкоспецифическим антигенам для определения риска развития онкозаболевания у человека
Аутоантитела к онкоспецифическим аутологическим антигенам являются потенциальными биомаркерами для выявления злокачественных новообразований с целью их ранней диагностики. Для улучшения возможности данного подхода в качестве антигена был предложен рекомбинантный белок, состоящий из нескольких пептидов. В качестве пептидов были выбраны фрагменты известных онкоспецифических аутоантигенов: альфа-фетопротеина, Myc, p53, erbB-2, S100-B, КRas, MAGE A3. Целью исследования была оценка возможностей полученной тест-системы. Показана возможность применения разработанной тест-системы на основе детекции опухоль-ассоциированных аутоантител для оценки риска развития онкозаболеваний.
Введение
Онкологические заболевания являются второй по значимости причиной смертности после заболеваний сердечно-сосудистой системы. По материалам «Состояние онкологической помощи населению России в 2021 году» до 40% раковых заболеваний, выявленных в 2021 году, были диагностированы на поздних (III-IV) стадиях [1]. В настоящее время существует ограниченное количество тестов с доказанной эффективностью для скрининговых исследований с целью раннего выявления рака. Прогностических тестов, позволяющих оценить риск развития онкозаболевания в ближайшие годы, нет, несмотря на активные исследования в этой области.
Наиболее перспективным направлением создания таких скрининговых тест-систем может стать метод определения уровня аутоантител к опухоль-ассоциированным антигенам (ОААГ). Такие ОААГ образуются в организме человека задолго до появления первых симптомов онкозаболевания [2] и могут служить основой для разработки новых методов диагностики и оценки онкориска. Динамическое наблюдение лиц, имеющих критический или повышающийся уровень ОААГ, позволит обнаружить онкологическое заболевание на ранней и сверхранней стадии. Целью данной работы было исследование возможности детекции известных из данных литературы последних лет ОААГ с целью выявления наиболее перспективных для дальнейшего использования аутоантител и дальнейшее исследование возможности применения для выявления уже имеющейся онкопатологии и оценки риска развития онкозаболевания у лиц без симптомов.
Результат литературного и патентного поиска
На основе данных литературы были выбраны как наиболее перспективные ОААГ следующие белки:
- MAGE A3 - цитоплазматический белок массой 35кДа, относящийся к группе раково-тестикулярных антигенов. Белок относится к семейству генов MAGE, которые экспрессируются в клетках мужской зародышевой линии и плаценте, а также при меланоме, раке мочевого пузыря, раке молочной железы, раке предстательной железы и раке легкого. MAGE-A3 обнаруживается при раке почек, яичников, семенников, нейробластоме, может повышать активность убиквитинлигазы, стимулирует убиквитинирование p53, что может играть роль в эмбриональном развитии организма, а также способствовать развитию процесса опухолевой трансформации. [3].
- MYC - ядерный белок массой 49 кДа, транскрипционный фактор, регулирующий экспрессию генов, связанных с ростом, соматическим перепрограммированием, самообновлением эмбриональных стволовых клеток, ангиогенезом. MYC также был идентифицирован как один из четырех генов, включая Sox2, Oct4 и KLF4, которые могут коллективно перепрограммировать фибробласты в состояние плюрипотентных стволовых клеток. [4] [5].
- Наиболее хорошо изученный белок p53 - цитоплазматический/ядерный белок массой 44 кДа, транскрипционный фактор. Белок p53 отрицательно регулирует клеточное деление, останавливает деление клетки в фазах G1, G2/M, вызывает остановку роста, апоптоз, некроз в зависимости от физиологических обстоятельств и типа клеток. Белок p53 участвует в регуляции репарации и рекомбинации ДНК, самообновления и дифференцировки стволовых клеток, а также в качестве барьера для образования раковых стволовых клеток. Мутантные варианты p53 приобретают новые функции, независимые от потери онкосупрессорной функции белка «дикого» типа, обеспечивая повышенную пролиферацию, ингибирование апоптоза, устойчивость к химиотерапии, ангиогенез и повышенную инвазивность опухоли. [6, 7].
- Внутриклеточный белок GTPase KRas (p21) массой 21 кДа принадлежит к семейству ГТФ-аз. Компонент системы передачи сигнала на цитоплазматической мембране, который связывает рецепторы на поверхности клетки с белками, передающими сигналы внутрь клетки. Участвует в регуляции пролиферации, миграции клеток, апоптоза. [8].
- ErbB-2 - мембранный белок массой 137 кДа, тирозиновая протеинкиназа семейства рецепторов эпидермального фактора роста. Может располагаться как на цитоплазматической мембране, так и на мембранах ядра. Участвует в передаче сигнала на поверхности клетки, организации цитоскелета клетки, регуляции транскрипции (рРНК, ингибитор циклинзависимых киназ). Сверхэкспрессируется при раке молочной железы, желудка, пищевода и других типах рака. ErbB-2 - мишень для терапевтических моноклональных антител и их конъюгатов. Аутоантитела к ErbB-2 были обнаружены при заболевании раком молочной железы. [7,9,10].
- Альфа-фетопротеин - секреторный белок массой 69 кДа, группы альфаглобулинов крови, широкоизвестный онкомаркер, который применяется в диагностике гепатоцеллюлярной карциномы. Аутоантитела к АФП были обнаружены у пациентов с гепатоцеллюлярной карциномой [11].
- S100B - внутриклеточный белок массой 11 кДа, связывающий ионы кальция и обнаруженный в клетках мозга, кожи и жировой ткани. Наличие S100B и аутоантител к S100B наблюдается у онкологических больных при метастазировании в мозг рака легких. S100 применяется в качестве биомаркера для скрининга, мониторинга и прогнозирования развития такого онкологического заболевания как меланома кожи [12,13].
Использование аутоантител в качестве биомаркеров по сравнению с обычными белковыми антигенами имеет ряд преимуществ [14]:
- Количество аутоантител в крови больше, чем ассоциированных с опухолью антигенов, за счет усиливающего эффекта гуморального иммунитета.
- Аутоантитела имеют более высокую стабильность и более длительный период полувыведения, чем ассоциированные с опухолью антигены.
- Аутоантитела могут быть обнаружены на более ранних стадиях развития болезни до появления других клинических симптомов, проявляющихся при развитии опухоли.
- Наличие аутоантител к разным антигенам отражает молекулярные характеристики опухоли, помогая идентифицировать текущие изменения, например, в сторону метастатического фенотипа.
- Определение аутоантител - это относительно простая, неинвазивная процедура, удобная для массового применения в клинической практике.
Таким образом, разработка тест-системы для детекции панели аутоантител к набору онкоспецифических аутоантигенов представляет собой перспективный подход для выявления рака на ранних его стадиях с большой степенью достоверности и специфичности. Важным вопросом, который следует решить, является разработка методов оценки уровня образования аутоантител в крови человека.
Материалы и методы
Образцы
Для исследования были использованы образцы сыворотки крови, полученные от пациентов с верифицированным диагнозом хронических заболеваний (29 женщин, 19 мужчин), а также от пациентов с верифицированным диагнозом онкологических заболеваний (38 женщин, 22 мужчины). В качестве контрольной группы были использованы сыворотки крови здоровых людей, не предъявляющих на момент забора крови каких-либо жалоб (33 женщины, 27 мужчин).
Образцы сыворотки перед замораживанием делили на аликвоты, хранили при -20°С.
Разработка ИФА тест-системы
В качестве антигена был использован рекомбинантный белок, состоящий из пептидных фрагментов белков Myc, p53, erbB-2, S100-B, КRas, MAGE A3, альфа-фетопротеина, соединенных линкерными последовательностями. Выбор пептидов производился по литературным данным (https://pubmed.ncbi.nlm.nih.gov/) по обнаружению аутоантител к выбранным белкам в крови онкологических пациентов и на основании последовательности белков (https://www.uniprot.org).
Синтез гена, внедрение в плазмиду, получение трансформированной культуры E.coli и наработка, выделение и очистка белка проведены ООО «АТГ Сервис Ген» по разработанным и утвержденным в компании методикам.
Для получения ИФА тест-системы на плашки для ИФА (NEST 514201 96 Well ELISA Plate) сорбировали антиген (рекомбинатный белок 5 мкг/мл 100 мМ карбонат-бикарбонатный буфер рН=9,5), при +5°С в течение12 часов. После двукратной отмывки Н2Одист блокировали 12 часов при +5°С, после чего вновь дважды отмывали буфером (ФБ, 2М NaCl, 1% Tween 20) и и дважды Н2Одист, удаляли остатки воды и высушивали. Готовые плашки хранили при +5°С в герметичном пакете с осушителем.
Постановка ИФА
Образцы сыворотки разводили 1:200 буфером (10мМ ФБ, 1,5М NaCl, 0,5% Tween 20). Вносили 100мкл/лунку и инкубировали в течение ночи при +4оС. Для контроля фонового сигнала оставили лунки, заполненные буфером без образца сыворотки. Для сравнения результатов анализа на разных планшетах поставили лунки с контрольными образцами (10мМ ФБ, 2М NaCl, 1% Tween 20, 0,1 мг/мл иммуноглобулин человека нормальный, АО «НПО «Микроген»😉, одинаковые на всех планшетах.
После троекратной отмывки буфером (10мМ ФБ, 2М NaCl, 1% Tween 20) вносили конъюгат пероксидазы хрена (ООО «ИМТЕК» P-RAH) в буфере (10мМ ФБ, 1,5М NaCl, 0,5% Tween 20) в разведение 1:40000 и инкубировали 1,5 часа при +37°С. Отмывали 2 раза буфером (10мМ ФБ, 2М NaCl, 1% Tween 20) и 2 раза Н2Одист. Вносили в лунки субстрат для реакции (60мМ гидрофосфат натрия, 40мМ цитрат натрия, 0,005% Н2О2, 1% ДМСО, 0,01% ТМБ). Инкубировали 15 мин при комнатной температуре в темноте на шейкере. Для остановки реакции добавляли 30 мкл 5% раствора H2SO4. Оптическую плотность детектировали при длине волны 450 нм с помощью анализатора иммуноферментных реакций (АИФР-01 УНИПЛАН).
Обработку полученных данных проводили с помощью программ MO Excel, Statistica. Вычисляли среднее по двум повторным измерениям.
Вычитали из всех образцов фоновый сигнал (пустые лунки без сыворотки). По значениям контрольных образцов (одинаковые на каждой планшете) вычисляли поправочный коэффициент, на который перемножали результаты, полученные на разных планшетах. Для групп (здоровые пациенты, хронические больные, онкологические больные) вычисляли средние значения, график размаха, достоверность различий между группами, график чувствительности и специфичности, пограничное значение, AUC. Полученные данные классифицировали по группам риска.
Результаты
Распределение и статистическая обработка
При анализе полученных данных было обнаружено, что оптические плотности выборок распределены ненормально. Имеет место значительный индивидуальный разброс внутри каждой из групп. Результаты статистической обработки представлены в таблице 1.
| Здоровые | Онкобольные | Хронические больные | |
|---|---|---|---|
| Среднее ± доверительный интервал | 0,69±0,09 | 0,79±0,1 | 1,16±0,19 |
| Количество в группе ( N ) | 60 | 60 | 48 |
Конкретные индивидуальные данные представлены на рисунках 1-3.
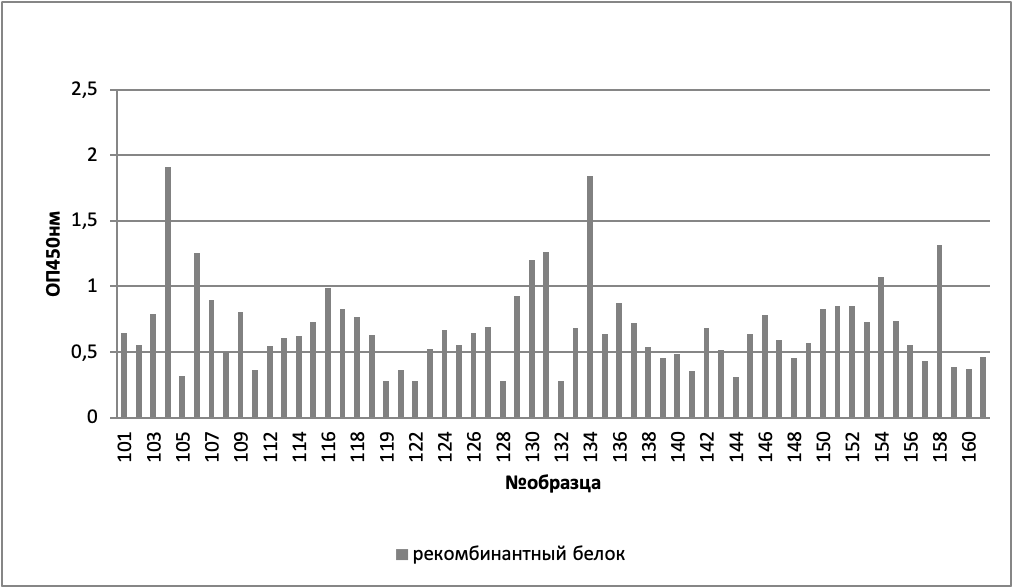
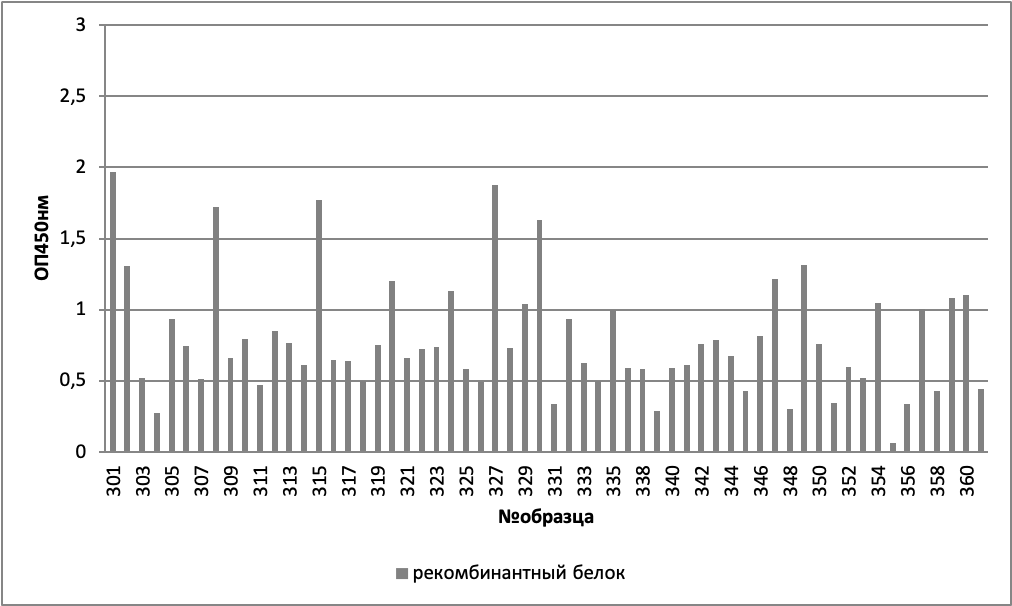
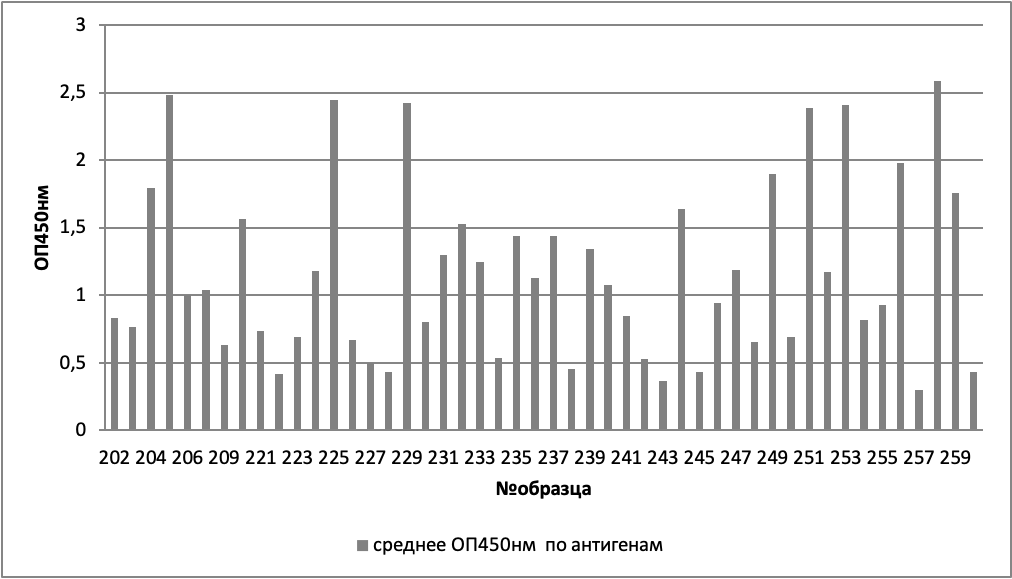
При анализе зависимости оптической плотности от пола и группы (здоровых, хронических больных, онкологических больных), было выявлено, что достоверные отличия (критерий Манна-Уитни p<0,05) наблюдаются между мужчинами и женщинами в группе хронических больных (таблицы 2, 3, рисунок 4).
| Мужчины | Здоровые | Онкобольные | Хронические больные |
|---|---|---|---|
| Среднее ± доверительный интервал | 0,67±0,13 | 0,78±0,19 | 1,43±0,32 |
| Количество в группе ( N ) | 27 | 22 | 19 |
| Женщины | Здоровые | Онкобольные | Хронические больные |
|---|---|---|---|
| Среднее ± доверительный интервал | 0,71±0,13 | 0,79±0,13 | 0,98±0,23 |
| Количество в группе ( N ) | 33 | 38 | 29 |
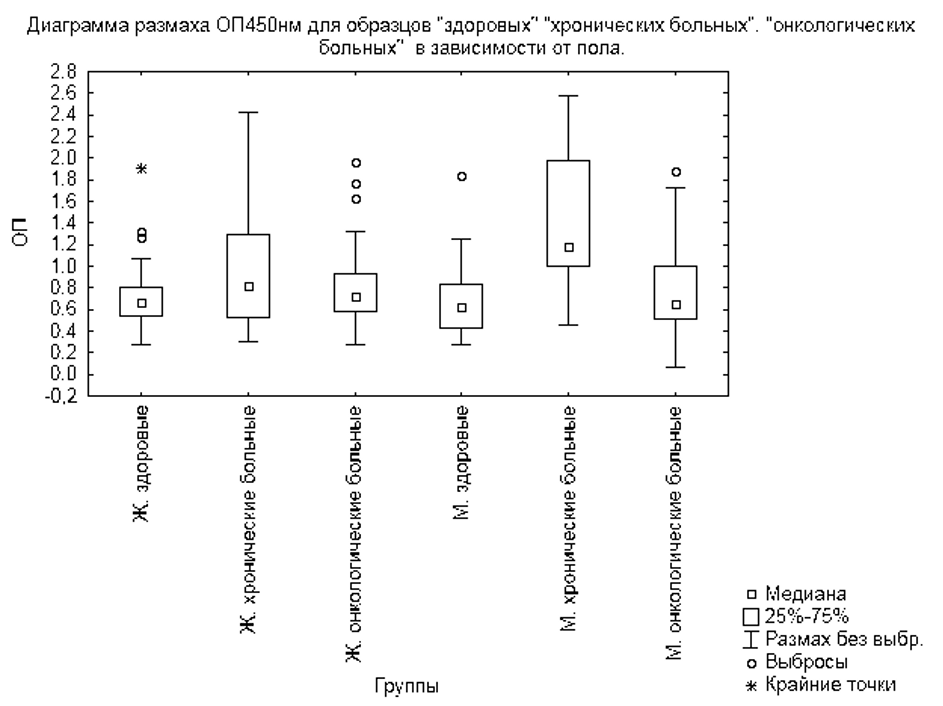
При анализе зависимости оптической плотности от группы (здоровых, онкологических больных (рисунок 5) не было выявлено достоверных отличий (критерий Манна-Уитни p>0,05) между группами здоровых и онкологических больных.
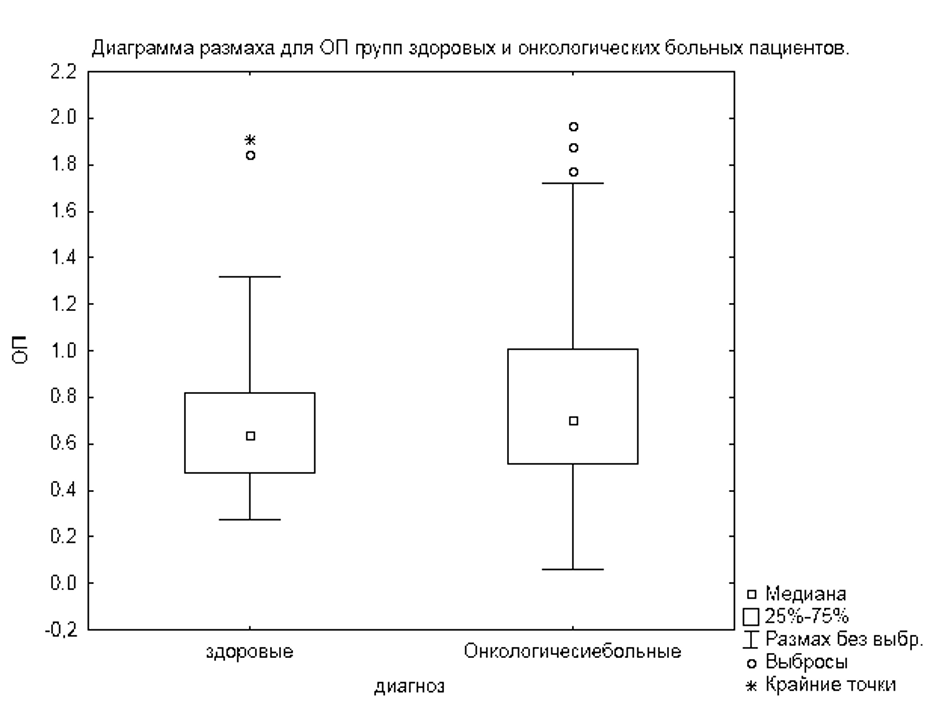
При анализе оптической плотности между группами не было выявлено достоверных отличий (критерий Манна-Уитни p>0,05) между подгруппами онкологических больных и здоровыми пациентами.
При исследовании образцов от пациентов с отдельными группами заболеваний, включая онкологические заболевания системы крови (хронический лимфолейкоз, хронический миелолейкоз), из группы онкологических болезней системы пищеварения (рак желудка), рак кожи, рак шейки матки, эти группы образцов продемонстрировали среднюю оптическую плотность значительно выше по сравнению с образцами от здоровых пациентов (таблица 4, рисунок 6).
| № образцов | Среднее ОП 450нм | Доверительный интервал |
|---|---|---|
| Здоровые | 60 | 0,69 |
| Рак системы кровообращения | 8 | 0,933 |
| Хронический лимфолейкоз | 5 | 1,085 |
| Хронический миелолейкоз | 2 | 0,872 |
| Лимфома | 1 | 0,298 |
| Рак органов пищеварительной системы | 7 | 0,82 |
| Рак кишечника | 3 | 0,565 |
| Рак желудка | 1 | 1,773 |
| Рак щитовидной железы | 1 | 0,591 |
| Рак поджелудочной железы | 2 | 0,738 |
| Рак молочной железы | 22 | 0,691 |
| Рак предстательной железы | 4 | 0,632 |
| Опухоль мозга | 2 | 0,72 |
| Рак мочевого пузыря | 3 | 0,618 |
| Рак кожи | 4 | 1,142 |
| Рак шейки матки | 4 | 0,83 |
| Рак почки | 5 | 0,718 |
| Рак гортани | 1 | 0,795 |
| Меланома | 1 | 0,646 |
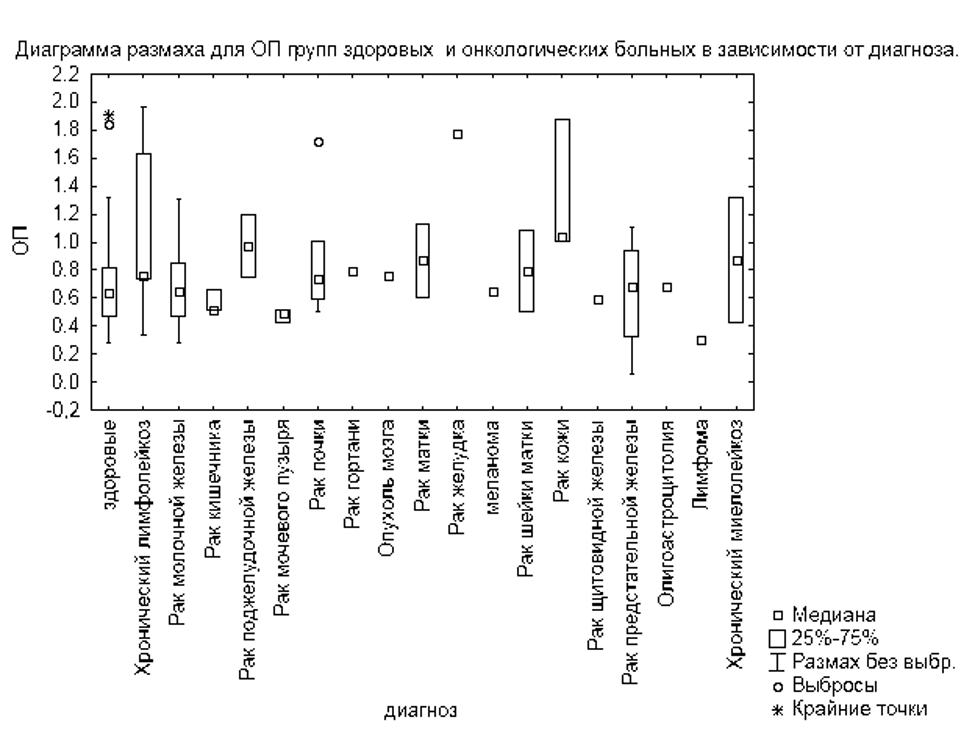
Диагностические характеристики
Для определения чувствительности и специфичности анализа были получены диагностические характеристики на основе оптической плотности здоровых пациентов (N=60) и хронических больных (N=48 )(рисунок 7). При анализе оптической плотности между группами было выявлено достоверное отличие (критерий Манна-Уитни p<0,05) между группами хронических больных и здоровыми пациентами. Две сыворотки группы здоровых людей (104, 134), которые представляли собой резко отличные от общей популяции «выбросы», были исключены из расчётов.
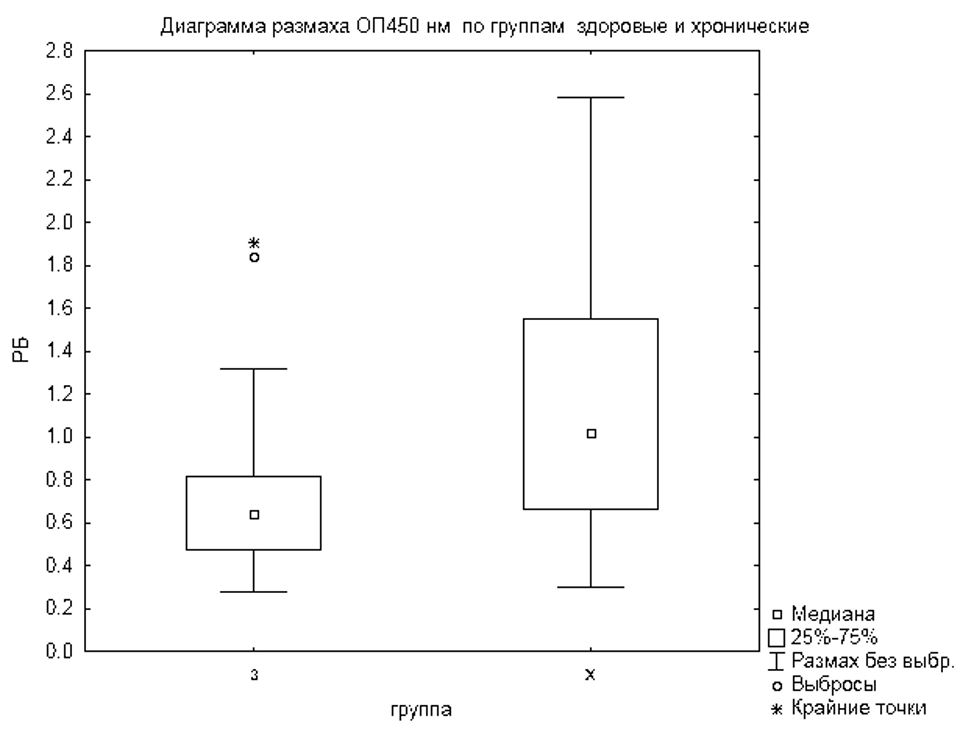
Чувствительность и специфичность рассчитывали по формуле: чувствительность = Х больных с сигналом больше или равным пограничному значению (Х больных с сигналом больше или равным пограничному значению + Х больных с сигналом меньше пограничного значения) ×100%; специфичность = Х здоровых с сигналом меньше пограничного значения (Х здоровых с сигналом больше или равным пограничному значению + Х здоровых с сигналом меньше пограничного значения) × 100%.
Например, при пороговом значении в 0,95 специфичность = 6 (58+6) × 100%= 90% чувствительность = 25 (25+23) ×100%=52%
| Пороговое значение оптической плотности | Чувствительность % | Специфичность % |
|---|---|---|
| 0,35 | 98 | 10 |
| 0,4 | 96 | 19 |
| 0,45 | 87,5 | 21 |
| 0,95 | 52 | 90 |
| 1,2 | 38 | 95 |
| 1,3 | 33 | 98 |
Для всего диапазона чувствительности и специфичности построили ROC-кривую (рисунок 8 ).
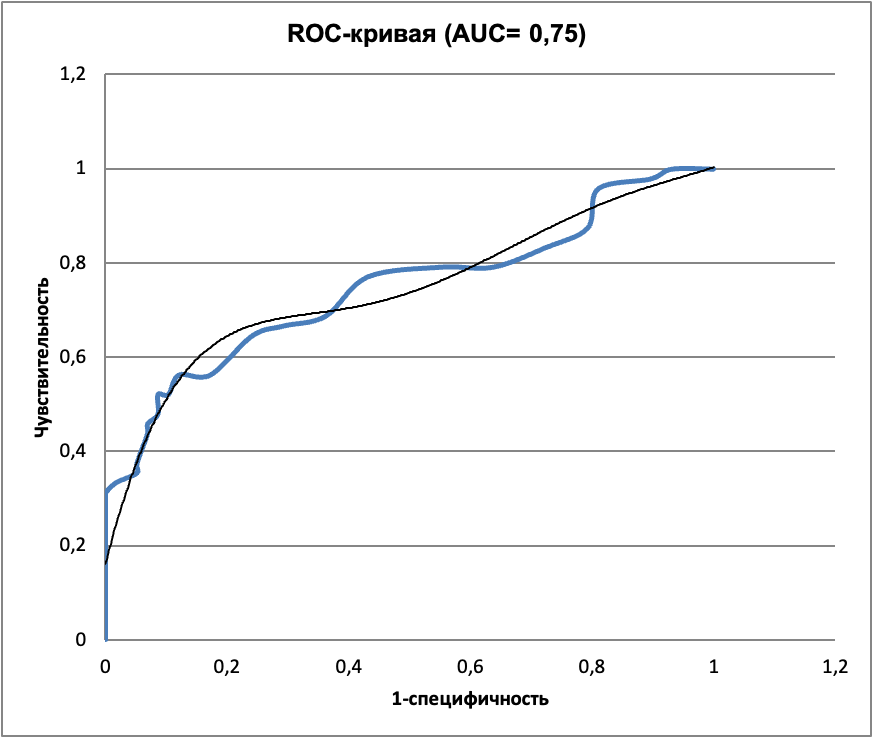
Было сделано заключение, что по данным статистического анализа диагностические свойства тест-системы недостаточны для выбора пограничного значения, обеспечивающего высокие значения и чувствительности, и специфичности (AUC = 0,75 < 0,9) (рисунок 8, таблица 5). Чувствительность и специфичность рекомбинантного белка для различения здоровых и онкологических больных также недостаточна (AUC = 0,53<<0,9).
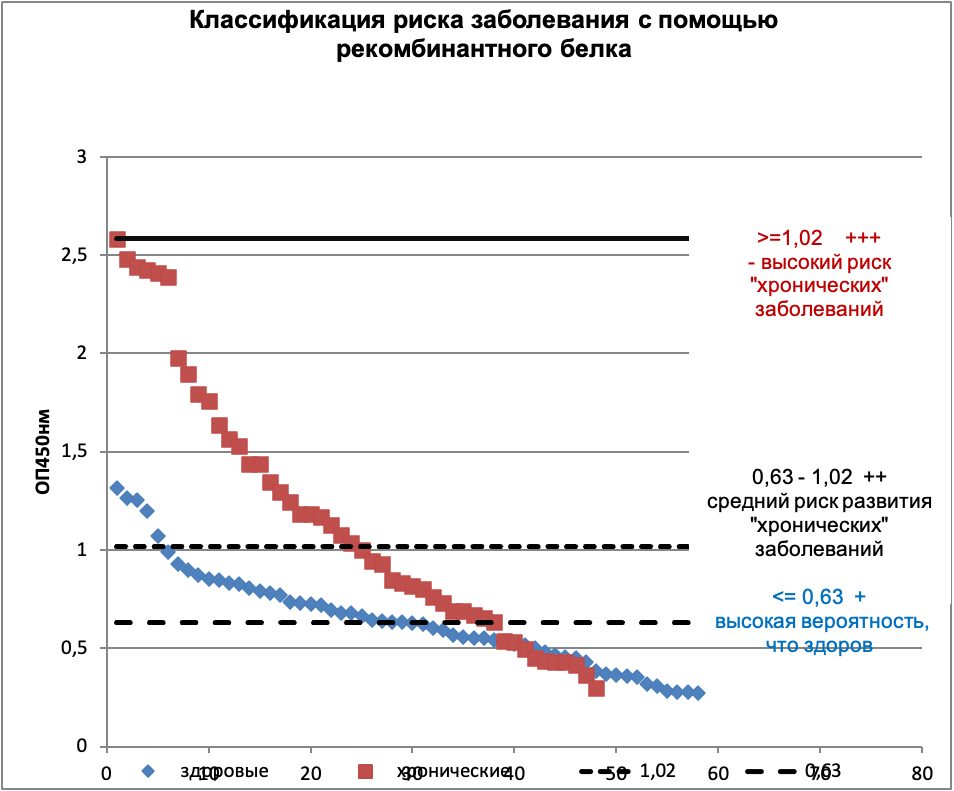
Для интерпретации полученных данных было предложено введение 3х групп для классификации по степеням риска. В этом случае по результатам ИФА анализа были введены критерии риска (таблица 6, рисунок 9).
| ОП 450 нм | здоровые | Хронические больные | Риск | |
|---|---|---|---|---|
| >=1,02 | 9% | 50% | +++ | повышенный риск обнаружения онкозаболеваний, включая предраковые /хронические заболевания |
| < 1,02; >0,63 | 41% | 29% | ++ | средний риск обнаружения онкозаболеваний, включая предраковые /хронические заболевания. |
| <0,63 | 50% | 21% | + | высокая вероятность, что пациент здоров |
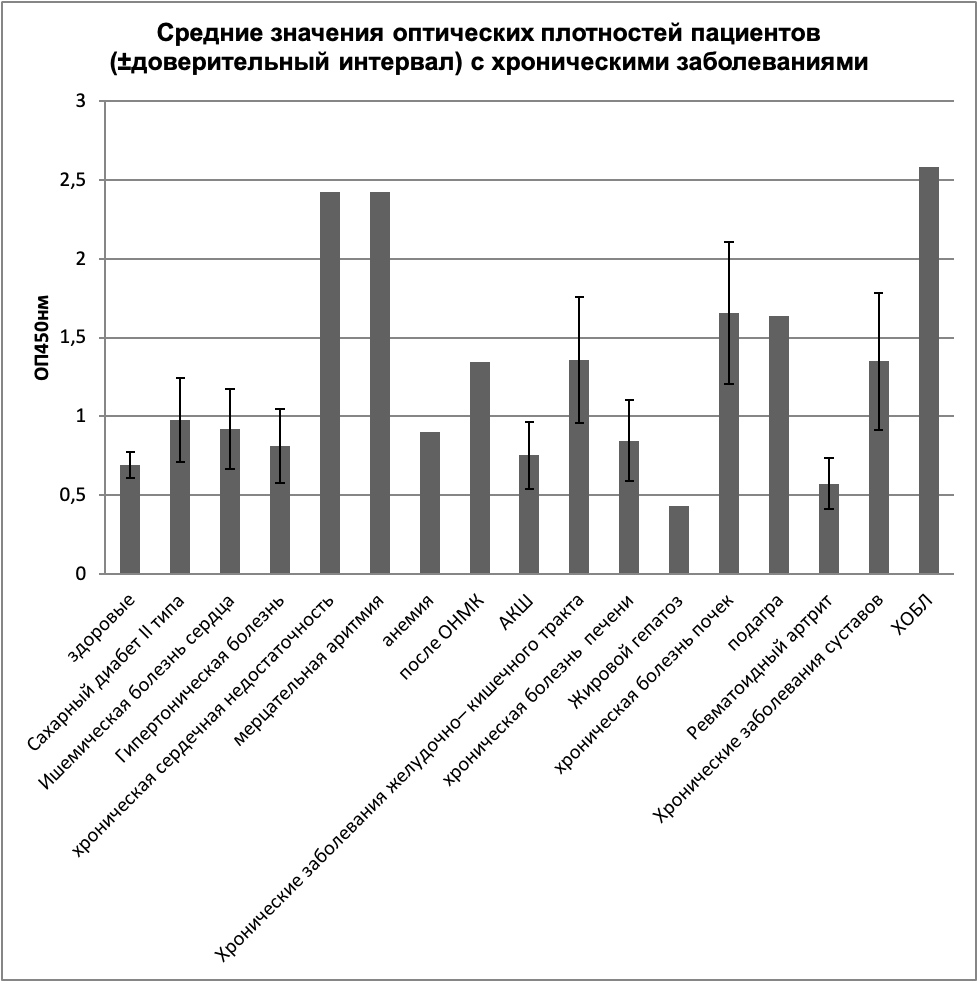
При разделении образцов по отдельным группам хронических заболеваний, в том числе: заболевания системы кровообращения (хроническая сердечная недостаточность, мерцательная аритмия), хронические заболевания желудочно-кишечного тракта, хроническая болезнь почек, хронические заболевания суставов, хроническая обструктивная болезнь легких, было замечено, что средняя оптическая плотность значительно выше в вышеперечисленных группах образцов хронических больных по сравнению с образцами от здоровых пациентов (рисунок 10).
Выводы
-
Проведенное пилотное исследование определения аутоантител к рекомбинантному белку продемонстрировало возможность выявления аутоантител в сыворотке крови человека с хроническими и онкологическими заболеваниями.
-
Диагностические возможности метода для различения здоровых пациентов от хронических больных определяются тем, что метод имеет низкую чувствительность (52%) при высоких значениях специфичности (90%) (пороговое значение 0,95 ед.опт.пл., AUC=0,75).
-
Метод определения аутоантител к рекомбинантному белку на настоящем этапе разработки не обнаруживает отличий между группами здоровых пациентов и онкологических больных и не может использоваться как диагностический (AUC≈0,5), требуя дальнейшей доработки.
-
Дальнейшие исследования позволят увеличить диагностические характеристики теста для выявления отдельных групп онкологических болезней, таких как раковые заболевания системы кровообращения (хронический лимфолейкоз, хронический миелолейкоз), онкологических болезней системы пищеварения (рак желудка), рак кожи, рак шейки матки.
-
Чувствительность и специфичность метода на настоящем этапе разработки недостаточны для выбора пограничного значения.
-
Введение 3х групп для классификации по степеням риска позволит использовать данный метод диагностики как прогностический тест для определения риска развития онкозаболеваний в будущем. Предлагается интерпретировать данные по оценке риска следующим образом:
- А) меньше или равно 0,63 - низкий риск «+» - высокая вероятность, что пациент здоров;
- Б) больше 0,63, но меньше 1,02 - средний риск «++» - средний риск обнаружения онкозаболеваний, включая предраковые /хронические заболевания;
- В) больше или равно 1,02 - высокий риск «+++» - повышенный риск обнаружения онкозаболеваний, включая предраковые /хронические заболевания.
Для уточнения степени риска предполагается провести расширенное и продолжительное исследование лиц, отнесенных к группе низкого, высокого и среднего риска.
Авторский коллектив:
- Мотовилов Д.Е.1
- Езерский В.А.1,2
- Хомякова Т.И.1,3
- Гончарова А.Я.1
- Розиев Р.А.1
- ООО «Научно-исследовательский технологический центр «Превентивной информационной медицины», Обнинск
- Всероссийский НИИ физиологии, биохимии и питания животных - филиал ФГБУ ФНЦЖ - ВИЖ им. академика Л. К. Эрнста, Боровск
- НИИ морфологии человека им. ак. А.П. Авцына ФГБНУ «РНЦХ им. акад. Б.В. Петровского», Москва
Список использованных источников
- «Состояние онкологической помощи населению России в 2021 году» Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой Состояние онкологической помощи населению России в 2021 году. − М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. − илл. - 239 с. ISBN 978-5-85502-275-9
- Heo CK, Bahk YY, Cho EW. Tumor-associated autoantibodies as diagnostic and prognostic biomarkers. BMB Rep. 2012 Dec;45(12):677-85. doi: 10.5483/bmbrep.2012.45.12.236. PMID: 23261052; PMCID: PMC4133814.
- Zhang B, Ren Z, Zhao J, Zhu Y, Huang B, Xiao C, Zhang Y, Deng J, Mao L, Tang L, Lan D, Gao L, Zhang H, Chen G, Luo OJ. Global analysis of HLA-A2 restricted MAGE-A3 tumor antigen epitopes and corresponding TCRs in non-small cell lung cancer. Theranostics. 2023 Aug 6;13(13):4449-4468. doi: 10.7150/thno.84710. PMID: 37649599; PMCID: PMC10465222.
- Kathrikolly T, Nair SN, Mathew A, Saxena PPU, Nair S. Can serum autoantibodies be a potential early detection biomarker for breast cancer in women? A diagnostic test accuracy review and meta-analysis. Syst Rev. 2022 Oct 9;11(1):215. doi: 10.1186/s13643-022-02088-y. PMID: 36210467; PMCID: PMC9549667.
- Li P, Shi JX, Dai LP, Chai YR, Zhang HF, Kankonde M, Kankonde P, Yu BF, Zhang JY. Serum anti-MDM2 and anti-c-Myc autoantibodies as biomarkers in the early detection of lung cancer. Oncoimmunology. 2016 Apr 22;5(5):e1138200. doi: 10.1080/2162402X.2016.1138200. PMID: 27467958; PMCID: PMC4910725.
- Zhang S, Carlsen L, Hernandez Borrero L, Seyhan AA, Tian X, El-Deiry WS. Advanced Strategies for Therapeutic Targeting of Wild-Type and Mutant p53 in Cancer. Biomolecules. 2022 Apr 6;12(4):548. doi: 10.3390/biom12040548. PMID: 35454137; PMCID: PMC9029346.
- Lu H, Ladd J, Feng Z, Wu M, Goodell V, Pitteri SJ, Li CI, Prentice R, Hanash SM, Disis ML. Evaluation of known oncoantibodies, HER2, p53, and cyclin B1, in prediagnostic breast cancer sera. Cancer Prev Res (Phila). 2012 Aug;5(8 :1036-43. doi: 10.1158/1940-6207.CAPR-11-0558
- Garcia-Robledo JE, Rosell R, Ruíz-Patiño A, Sotelo C, Arrieta O, Zatarain-Barrón L, Ordoñez C, Jaller E, Rojas L, Russo A, de Miguel-Pérez D, Rolfo C, Cardona AF. KRAS and MET in non-small-cell lung cancer: two of the new kids on the 'drivers' block. Ther Adv Respir Dis. 2022 Jan-Dec;16:17534666211066064. doi: 10.1177/17534666211066064. PMID: 35098800; PMCID: PMC8808025.
- Madera S, Izzo F, Chervo MF, Dupont A, Chiauzzi VA, Bruni S, Petrillo E, Merin SS, De Martino M, Montero D, Levit C, Lebersztein G, Anfuso F, Roldán Deamicis A, Mercogliano MF, Proietti CJ, Schillaci R, Elizalde PV, Cordo Russo RI. Halting ErbB-2 isoforms retrograde transport to the nucleus as a new theragnostic approach for triple-negative breast cancer. Cell Death Dis. 2022 May 9;13(5):447. doi: 10.1038/s41419-022-04855-0. PMID: 35534460; PMCID: PMC9084267.
- Masuda H, Zhang D, Bartholomeusz C, Doihara H, Hortobagyi GN, Ueno NT. Role of epidermal growth factor receptor in breast cancer. Breast Cancer Res Treat. 2012 Nov;136(2):331-45. doi: 10.1007/s10549-012-2289-9.
- Bei R., Gerald J. Mizejewski. Alpha-fetoprotein is an autoantigen in hepatocellular carcinoma and juvenile Batten disease. Front. Biosci. (Landmark Ed) 2020, 25(5), 912-929. https://doi.org/10.2741/4840
- Michetti F, Corvino V, Geloso MC, Lattanzi W, Bernardini C, Serpero L, Gazzolo D (March 2012). "The S100B protein in biological fluids: more than a lifelong biomarker of brain distress". J. Neurochem. 120 (5): 644-59. doi:10.1111/j.1471-4159.2011.07612.x.
- Peric B, Zagar I, Novakovic S, Zgajnar J, Hocevar M. Role of serum S100B and PET-CT in follow-up of patients with cutaneous melanoma. BMC Cancer. 2011 Aug 2;11:328. doi: 10.1186/1471-2407-11-328.
- Маршутина Н.В., Сергеева Н.С., Алентов И.И., Каприн А.Д. Аутоантитела против опухолеассоциированных антигенов как класс серологических маркеров. Успехи молекулярной онкологии 2019;6(1):10-7.

