Выпуск № 6 — 07/10/2022 Биология
МИКРОИГЛЫ – НОВЫЙ ПОДХОД К ДОСТАВКЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ (Обзор)
Резюме
В обзоре дано описание новой технологии для доставки лекарственных препаратов, лекарств на основе пептидов, вакцин, гормонов с помощью микроигл, причем основное внимание уделено использованию растворимых микроигл. Микроиглы появились как альтернативный метод трансдермального введения лекарств, они нашли применение во многих областях биомедицины, таких как терапия, диагностика и введение вакцин. Развитие технологии производства и применения микроигл продолжается, их качество постоянно повышается за счет применения инертных или биорастворимых материалов, а также таких преимуществ, как меньший дискомфорт при аппликации, возможность самостоятельного введения лекарственных средств, повышенная стабильность, удобство и безопасность применения. В обзоре также намечены перспективы развития данной технологии.
Ключевые слова: микроиглы, трансдермальное введение, вакцины, микролитье, платформа микроигл, растворимые микроиглы.
Введение
Микроиглы - это разрабатываемая в последнее время система доставки лекарств, посредством которой осуществляется малоинвазивное введение фармацевтических и косметических субстанций в кожу (белки, полисахариды, нуклеиновые кислоты, гормоны, вакцины и т.д.). Чрескожное введение лекарственных препаратов или вакцин обычно ассоциировано с болезненностью процедуры и негативным психологическим эффектом, который наиболее выражен у детей, но присутствует в той или иной мере и у взрослых людей, поэтому методы с менее выраженным болевым воздействием и сниженным чувством страха у пациента находят все большее применение в том числе в превентивной медицине. Кроме того, повреждение кожных покровов инъекционными иглами может привести к инфицированию и развитию постинъекционных осложнений. При нарушении правил асептики, а также при использовании нестерильных растворов формируется инфильтрат либо абсцесс. У иммуносупрессированных больных может развиться системная воспалительная реакция и сепсис, возможно заражение гепатитами В и С а также ВИЧ-инфекцией. Отдельный аспект данной проблемы - самотравмирование медицинских работников нестерильной иглой. Всемирная организация здравоохранения установила, что 37 % случаев заражения гепатитом В и 4,4 % ВИЧ возникает при травмировании кожных покровов, и медицинские работники входят в группу риска заражения этими гемоконтактными инфекциями [1]. Разработка способов безинъекционного пути введения лекарственных средств - важнейшая проблема медицины.
Одним из решений этой проблемы стала платформа, несущая на поверхности массив микроигл с нанесенным или инкапсулируемым лекарственным веществом в микроиглах (МИ). Они изучаются многими исследователями для преодоления ограничения традиционных подходов. МИ могут разрабатываться таким образом, что глубина проникновения в кожу зависит от цели введения от достаточно поверхностной до глубокой. В первом случае микроиглы не будут касаться нервных рецепторов, что обычно приводит к болезненному введению лекарств. МИ представляют собой массив на подложке с клейким защитным слоем, формирующим пластырь для нанесения на кожу [2]. Размеры платформы с МИ обычно составляют менее миллиметра в высоту. В предлагаемом обзоре рассматриваются пути развития и перспективы использования растворимых микроигл для доставки лекарственных препаратов, лекарств на основе пептидов, вакцин, гормонов. Концепция платформы с микроиглами возникла в конце 1970-х, но технологически тогда она не могла развиваться быстро. Вследствие развития нанотехнологий в 1990-е гг. МИ получали все большее внимание, и были открыты новые перспективы в клинической медицине [3]. Поскольку МИ не проникают глубже защитного слоя кожи, то и вероятность проникновения инфекции значительно меньше. Таким образом, применение микроигл более безопасно, чем обычная подкожная инъекция [4].
Трансдермальное введение лекарственных препаратов
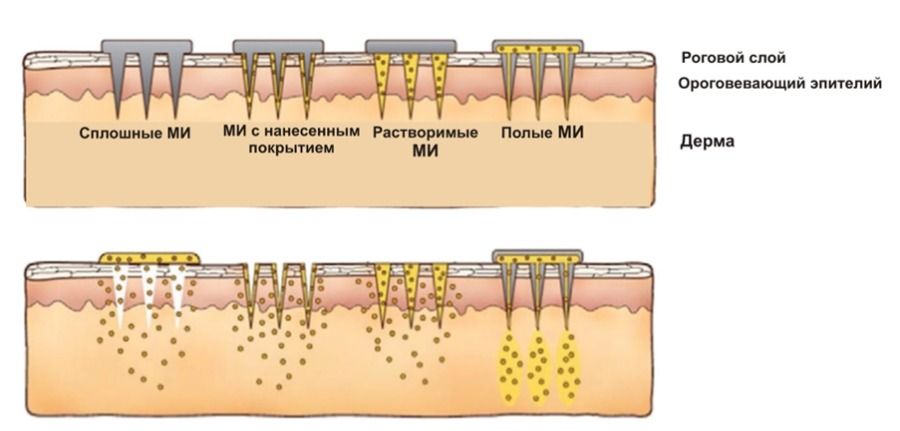
Кожа - самый большой наружный орган человеческого тела. Площадь кожи занимает около 1,8 кв.м, по массе она составляет примерно пятую часть от общей массы тела [5]. Кожа является барьером от широкого спектра внешних воздействий и защищает от проникновения в организм патогенов, токсинов, а также от вредного действия ультрафиолета. Она участвует в процессах терморегуляции, дыхания и многих других. Вследствие этих качеств кожа может рассматриваться как важнейшая область для селективного и неинвазивного пути доставки лекарств. Трансдермальная терапевтическая система (ТТС) - это дозированная мягкая лекарственная форма для наружного применения в форме пластырей или пленок, высвобождающая лекарственное средство в течение определенного времени [6]. При трансдермальном введении лекарств снимается ряд вопросов, связанных с пероральным введением, таких как желудочное раздражение, лучшее высвобождение лекарств с течением времени по сравнению с пероральным введением [7]. Простота применения, безболезненность, безопасность, отсутствие необходимости частого приема - положительные качества ТТС. Примерами препаратов, для введения которых применяются ТТС, являются скопаламин (Transderm-Scop), фентанил (Lexicomp-Online), никотин (Nicoderm) [7], диклофенак, лидокаин, нитроглицерин, эстрадиол и др. [6]. При трансдермальном введении имеется ряд ограничений, прежде всего связанных с необходимостью преодоления рогового слоя кожи, который выступает как первый защитный слой и ограничивает всасывание лекарства. При трансдермальном введении к лекарству предъявляется ряд требований: молекулярный вес вещества не должен быть более 600 Да, хорошая проницаемость через кожу, низкая точка плавления, хорошая растворимость, отсутствие заряда на молекуле вещества. Следовательно, не все лекарства отвечают этим требованиям. На первом этапе разработок ТТС были использованы пластыри, которые и до настоящего времени применяются в широкой практике. Количество лекарственных препаратов в этом случае невысокое, и они должны соответствовать диапазону молекулярной массы, гидрофильности и эффективности при низкой дозировке. К достоинствам такой формы можно отнести простоту применения и достаточно низкую стоимость изготовления. Следующим этапом развития ТТС было применение методов ионофореза, сонофореза, - активаторов переноса лекарственных веществ. Эти методы позволяют увеличить дозу проникающих веществ, и, соответственно, эффективность воздействия, но требуют применения аппаратов и медицинского персонала для применения в практике. Третьим этапом стали новые активаторы переноса лекарственных веществ, МИ, что позволило большим молекулам лучше проникать во внешний слой кожи [7]. В последние годы технология микроигл стремительно развивается, это позволяет использовать лекарственные вещества с большой молекулярной массой по сравнению с другими методами трансдермальной терапевтической системы. Посредством микроканалов, создаваемых микроиглами во внешнем слое кожи, лекарственные вещества проникают во внешний роговой слой кожи. При этом они не затрагивают нервные окончания в коже, таким образом болевой эффект от процедуры сводится к минимуму или полностью отсутствует. С помощью микроигл можно обеспечить трансдермальное введение белков, пептидов, антител, вакцин и лекарственных веществ с плохой эффективностью в низких дозах. Также пациенты могут вводить лекарственный препарат самостоятельно. С развитием нанотехнологий разработкой микроигл занимались многие фармацевтические компании [8]. МИ разделяют на следующие категории: сплошные, полые, с нанесенным покрытием и растворимые. Сплошные МИ изготавливаются из инертных материалов, таких как нержавеющая сталь, титан, кремний. Их роль: сделать каналы в коже, через которые наносимый лекарственный препарат проникает за пределы рогового слоя. Полые МИ изготавливаются из тех же инертных материалов, что и сплошные МИ. Полые МИ конструктивно имеют полые каналы внутри каждой иглы, которые позволяют доставлять лекарственный препарат через отверстия в кожу аналогично обычным иглам, но без упомянутых недостатков. МИ с нанесенным покрытием похожи на сплошные МИ и выполнены из инертных материалов, таких как нержавеющая сталь или титан, покрыты необходимым составом посредством погружения или распылением состава на МИ. Растворимые МИ отличаются от предыдущих трех категорий тем, что изготавливаются из материалов, которые растворяются после введения в кожу [2].
Типы, разновидности, материалы для изготовления микроигл
МИ представляют собой пластинку, на поверхности которой находится массив от 10 до1000 микроигл. Размеры микроигл колеблются от 100 до 1000 мкм. МИ можно разделить на четыре основные группы: сплошные, полые, с нанесенным покрытием и растворимые (Рисунок 1) [8]. Растворимые МИ могут быть выполнены из полимера с лекарственным веществом (или веществами), распределенным равномерно по всему объему иглы. Существуют также многослойные МИ, где игла состоит из нескольких слоев полимера с разным лекарственным веществом. По внешнему виду МИ подразделяются на конические, пирамидальные, каплевидные и сложной формы.
Рисунок 1 - Разновидности микроигл
Сплошные МИ
Сплошные или твердотельные МИ были разработаны в 1998 г. Они используются для предварительной обработки кожи с целью создания микроканалов, увеличивающих проницаемость кожи. Затем поверх этих каналов прикладывается пластырь с лекарственным веществом или другой лекарственной формой для местного применения, например, гель, мазь, крем, раствор. Далее лекарственное вещество из пластыря или другой лекарственной формы проникает через эти микроканалы. В результате улучшается введение лекарственных веществ, таких как каптоприл и метопролола тартрат, через роговой слой кожи [9]. Сплошные МИ просты в изготовлении, имеют повышенную механическую прочность. Они изготавливаются из кремния, стекла, титана, нержавеющей стали и др. Для производства микроигл из кремния используется процесс глубокого реактивного ионного травления [8]. МИ из нержавеющей стали изготавливаются с помощью микрофрезерной технологии, лазерной резки, влажного травления фотолитографически [8]. Также сплошные МИ могут быть произведены из полимеров методами микролитья, 3D-печати [10].
МИ с нанесенным покрытием
МИ с покрытием - это те же сплошные МИ, на которые в процессе производства наносится лекарственное вещество. Описано множество методов для изготовления микроигл с покрытием [8]. Покрытие на МИ осуществляется методом погружения микроигл в раствор или напылением раствора на иглы. Один из методов нанесения покрытия на МИ заключается в использовании электрогидродинамического распыления [11]. Методы литографии применялись для нанесения рисунка на фольгу, имитирующего структуру кожи, с последующим нанесением фольги на МИ [12]. Эти МИ имеют преимущества над сплошными МИ, такие, как отсутствие реакции иммунной системы на сами МИ, практически безболезненное введение, что позволяет использовать МИ на более чувствительных участках кожи. После прокола кожи микроиглами с покрытием лекарственное вещество растворяется в коже и диффундирует в систему микроциркуляции. После введения микроиглы могут быть удалены [11]. Помимо введения лекарственных веществ МИ также могут быть использованы как электроды для измерения электрических характеристик кожи и соответствующих органов [13].
Полые МИ
Полые МИ состоят из резервуара для лекарственного вещества и полого отверстия в центре иглы. Введение лекарственного вещества осуществляется посредством управления давлением или электричеством потока раствора лекарственного вещества с помощью насоса, шприца или газа под давлением [10]. Полые МИ также проходят роговой слой кожи, и лекарственное вещество попадает в нижние слои эпидермиса. При изготовлении полых микроигл используются методы изотропного травления [11], лазерная микрообработка [8], комплексное литографическое литье методом жидкостного химического травления и рентгеновской фотолитографии [8]. Для изготовления полых микроигл используют следующие материалы: монокристалл кремния [9], нержавеющая сталь [8], полимолочная кислота [8], углеродные нанотрубки [8], полиметилметакрилат [8], стекло и керамика [10]. Полые МИ применяют для введения высокомолекулярных веществ, таких как белки, олигонуклеотиды, вакцины. Также их используют для трансдермальной доставки инсулина [8,9], биомедицинской диагностики [4].
Растворимые МИ
Растворимые МИ разработаны таким образом, что после введения они полностью растворяются в коже, не оставляя никаких следов. Растворимые МИ работают на основе принципа «нажми и отпусти». При производстве микроигл используются биосовместимые и водорастворимые материалы, которые смешиваются с лекарственным веществом. В отличие от других типов микроигл растворимые МИ после проникновения в кожу растворяются в ней, выделяя лекарственное вещество. Они имеют ряд преимуществ: упрощенное изготовление, удобство в применении, высокая лекарственная нагрузка [14]. При изготовлении микроигл обычно используют микроформы, которые заполняют раствором полимера с лекарственным веществом [15]. Процесс производства состоит из заливки полимерного раствора в микроформы, заполнение микрополостей формы с помощью центрифугирования, под вакуумом или давлением, сушка при комнатной температуре и давлении. В качестве основы для растворимых микроигл используются различные вещества: силикон [16], поливиниловый спирт [2, 19, 21], поливинилпирролидон [17, 19], карбоксиметилцеллюлоза [2, 21], гиалуроновая кислота [18, 21], поливинилацетат[2], полимолочная кислота [2, 14], желатин [2], хондроитин сульфат [2, 21, 22], сорбит [2, 20], сахароза [2, 22], трегалоза [2, 19, 22], декстран 70 [20], полиакриламид [2], полиакриловая кислота [22] и др. По форме растворимые МИ могут быть конические, пирамидальные и сложной формы. Растворимой может быть часть иглы, например, только кончик [23]. Растворимая часть может быть расположена на твердой нерастворимой основе [23]. После введения растворимая часть остается в коже, а твердая основа отделяется и удаляется. С помощью двухфотонной полимеризации можно создать более сложные формы микроигл [24]. Такие модификации позволяют осуществлять быструю доставку лекарственных веществ и их контролируемое высвобождение.
Использование микроигл
МИ все больше играют важную роль в медицине и косметологии. Первым продуктом с использованием микроигл, поступившим на рынок, был дермароллер [23]. Растворимые МИ с гиалуроновой кислотой широко используются в косметологии. Все эти продукты появились на рынке недавно и становятся все более популярными [15].
Лекарственные формы, разработанные с использованием микроигл
Введение лидокаина с помощью микроигл более комфортно и более эффективно по сравнению с подкожным введением [23]. Для лечения нейропатической боли использовались растворимые МИ с мелоксикамом [23]. Разработаны химиотерапевтические методы лечения рака с использованием микроигл для введения различных противоопухолевых препаратов, таких как цисплатин и доксорубицин [25], 5-фторурацил, тамоксифен и гемцитабин [23]. Локализованное введение этих препаратов помогает уменьшить побочные эффекты. Для лечения диабета использовали МИ с инсулином [8, 9, 25, 26] и эксендин-4 [26]. МИ с паратиреоидным гормоном применяют для лечения остеопороза [26]. Были разработаны пластыри с микроиглами, наполненные такими лекарственными веществами как левоноргестрел, прогестерон, этоногестрел в качестве гормональной контрацепции [26]. МИ с антиретровирусными препаратами (рилпивирин, ацикловир, ламивудин) позволили улучшить стабильность препаратов, повысить степень проникновения через кожу и повысить параметры местного распределения [25].
Трансдермальное введение лекарственных препаратов с высокой молекулярной массой ограничено из-за барьерных свойств рогового слоя. Эту проблему помогают решить МИ - была показана эффективность метода лечения хронической тромбоэмболии при использовании микроигл с гепарином [27]. Исследования по введению пептидов с помощью микроигл показали, что растворимые МИ способны доставлять пептиды через роговой слой кожи. Также сохраняется стабильность пептидов на этапах разработки, применения и доставки [28].
Разработка вакцин на основе микроигл
Трансдермальное введение вакцин с использованием растворимых микроигл является быстро развивающейся областью исследований. Введение вакцин с помощью микроигл имеет преимущества по сравнению с внутримышечным и подкожным введением. Так как МИ обеспечивают введение вакцины в эпидермис и область дермы, которая содержит много клеток Лангерганса и дендритных клеток, вакцина при таком пути введения вызывает более выраженный иммунный ответ.
Использование технологии МИ для вакцинации имеет ряд преимуществ. Такой способ введения вакцин не требует привлечения высококвалифицированного персонала, что может быть полезно, например, во время массовых вакцинаций [30]. Применение стерильно упакованных в МИ с нанесенной вакциной снижает риск постинъекционных осложнений и исключает риск заражения гепатитом и ВИЧ путем самотравматизации нестерильными иглами у медперсонала.
Исследования по применению микроигл для вакцинации против гриппа показали выработку сильных антител и клеточные иммунные реакции у мышей, обеспечивающие полную защиту от летального заражения [31]. Проведенные исследования на людях показали, что вакцинация против гриппа с использованием микроигл хорошо переносится и вызывает сильный иммунологический ответ (Рисунок 2 ) [32].
Пластыри с микроиглами, разработанные для введения инактивированной вакцины против полиомиелита, показали более качественную термостабильность при длительном хранении при повышенной температуре по сравнению с обычной жидкой вакциной [33]. Стабильность вакцин в микроиглах при комнатной температуре также была приведена в работе [34]. В работе представлена система «VaxiPatch», которая состоит из субъединичных гликопротеиновых вакцинных антигенов, адъювантов и трансдермальной системы доставки. МИ с разными вакцинами прошли доклинические и клинические испытания. Была показана улучшенная стабильность, безопасность и иммунологическая эффективность по сравнению с обычным введением вакцин [35]. Использование микроигл с овальбумином как модельного антигена для получения иммунного ответа говорит о применении микроигл в дальнейшем для введения антигенов [36]. Разработка микроигл с лиофильной вакциной гриппа сохраняла активность при изготовлении и последующем хранении в течение 3 месяцев при 40°С и вызывала сильный иммунный ответ в мышиной модели [37]. Использование микроигл для вакцинации улучшает логистику и повышает стабильность. Это было показано в работе на примере пластыря с микроиглами двухкомпонентной вакцины против кори и краснухи [38]. Помимо логистики и стабильности МИ позволяют обеспечить контролируемое высвобождение вакцины в течение определенного времени. Таким образом, сокращается необходимость в многократных инъекциях [39]. Последние 10 лет интерес к применению микроигл для вакцинации очень возрос, написано множество научных работ, получены патенты, ведутся исследования [40]. На данный момент МИ с вакцинами находятся на разных стадиях клинических испытаний [41].
Заключение
Таким образом, применение технологии микроигл является перспективным путем безопасного и эффективного введения лекарственных средств как в стационаре, так и амбулаторно. Простота и низкое болевое воздействие применения МИ позволяет увеличить охват населения вакцинацией. Применение платформы с микроиглами для иммунизации может быть более эффективно, чем при обычном внутримышечном введении. МИ позволяют решить такие вопросы как обеспечение термостабильности при хранении и транспортировке. Важнейшими преимуществами технологии являются снижение дозы действующего вещества, простота использования, отсутствие острых предметов и простота их дальнейшей утилизации, минимальные болевые ощущения или их полное отсутствие при применении. При современном развитии технологий есть все необходимые компоненты для создания отечественного производства микроигл. Благодаря постоянной научно-исследовательской работе использование МИ в ближайшее десятилетие будет играть ведущую роль при иммунизации и лечении хронических неинфекционных заболеваний.
Список использованных источников
- Riddell A, Kennedy I, Tong CY. Management of sharps injuries in the healthcare setting. //BMJ. 2015 Jul 29;351:h3733. doi: 10.1136/bmj.h3733. PMID: 26223519.
- Moore LE, Vucen S, Moore AC. Trends in drug- and vaccine-based dissolvable microneedle materials and methods of fabrication.// Eur J Pharm Biopharm. 2022 Apr;173:54-72. doi: 10.1016/j.ejpb.2022.02.013. Epub 2022 Feb 25. PMID: 35219862.
- Li J, Zeng M, Shan H, Tong C. Microneedle Patches as Drug and Vaccine Delivery Platform.// Curr Med Chem. 2017;24(22):2413-2422. doi: 10.2174/0929867324666170526124053. PMID: 28552053.
- Романюк А.В., Звездин В.Н., Самант П., Землянова М.А., Праузнитц М.Р., Устинова О.Ю. Разработка микроигольных аппликаторов для биомедицинской диагностики // Фундаментальные исследования. - 2013. - № 12-2. - С. 319-326.
- Marc B. Brown, Adrian C. Williams. The Art and Science of Dermal Formulation Development.// 2019. doi.org/10.1201/9780429059872.
- Кузнецова Е.Г., Рыжикова В.А., Саломатина Л.А., Севастьянов В.И. Трансдермальный перенос лекарственных веществ и способы его усиления.// Вестник трансплантологии и искусственных органов. 2016;18(2):152-162. doi.org/10.15825/1995-1191-2016-2-152-162.
- Ahmed Saeed Al-Japairai K, Mahmood S, Hamed Almurisi S, Reddy Venugopal J, Rebhi Hilles A, Azmana M, Raman S. Current trends in polymer microneedle for transdermal drug delivery.// Int J Pharm. 2020 Sep 25;587:119673. doi: 10.1016/j.ijpharm.2020.119673. Epub 2020 Jul 30. PMID: 32739388.
- Ita K. Transdermal Delivery of Drugs with Microneedles-Potential and Challenges.// Pharmaceutics. 2015 Jun 29;7(3):90-105. doi: 10.3390/pharmaceutics7030090. PMID: 26131647.
- Gupta J, Gupta R, Vanshita. Microneedle Technology: An Insight into Recent Advancements and Future Trends in Drug and Vaccine Delivery. Assay Drug Dev Technol. // 2021 Feb-Mar;19(2):97-114. doi: 10.1089/adt.2020.1022. Epub 2020 Dec 9. PMID: 33297823.
- Sirbubalo M, Tucak A, Muhamedagic K, Hindija L, Rahić O, Hadžiabdić J, Cekic A, Begic-Hajdarevic D, Cohodar Husic M, Dervišević A, Vranić E. 3D Printing-A "Touch-Button" Approach to Manufacture Microneedles for Transdermal Drug Delivery.// Pharmaceutics. 2021 Jun 22;13(7):924. doi: 10.3390/pharmaceutics13070924. PMID: 34206285.
- , & ND. S. (2019). Review of Microneedle based Transdermal Drug Delivery Systems.// International Journal of Pharmaceutical Sciences and Nanotechnology, 12(3), 4511-4523. https://doi.org/10.37285/ijpsn.2019.12.3.1.
- Jiawook RN. Manufacturing nanoimprint lithography system to produce efficient microneedles patch for transdermal drug delivery.// J Appl Biotechnol Bioeng. 2017;3(3):321-324. doi: 10.15406/jabb.2017.03.00065.
- Miyako Arai, Yuya Nishinaka, and Norihisa Miki. Electroencephalogram measurement using polymer-based dry microneedle electrode.// 2015 Jpn. J. Appl. Phys. 54.
- He X, Sun J, Zhuang J, Xu H, Liu Y, Wu D. Microneedle System for Transdermal Drug and Vaccine Delivery: Devices, Safety, and Prospects.// Dose-Response. October 2019. doi:10.1177/1559325819878585.
- Manoj, V. R., and H. Manoj. Review on transdermal microneedle-based drug delivery.// Asian Journal of Pharmaceutical and Clinical Research, vol. 12, no. 1, Jan. 2019, pp. 18-29, doi:10.22159/ajpcr.2019.v12i1.27434.
- Jing Ji et al. Microfabricated Silicon Microneedle Array for Transdermal Drug Delivery. // 2006 J. Phys.: Conf. Ser. 34 1127.
- S. Shim et al. Role of Polyvinylpyrrolidone in Dissolving Microneedle for Efficient Transdermal Drug Delivery: In vitro and Clinical Studies. // Bull. Korean Chem. Soc. 2018 June, Volume 39, Issue 6 Pages 789-793. doi.org/10.1002/bkcs.11476.
- Zvezdin V, Peno-Mazzarino L, Radionov N, Kasatkina T, Kasatkin I. Microneedle patch based on dissolving, detachable microneedle technology for improved skin quality - Part 1: ex vivo safety evaluation. // Int J Cosmet Sci. 2020 Aug;42(4):369-376.
doi: 10.1111/ics.12627. Epub 2020 Jul 5. PMID: 32412648. - Микроиглы и способы их изготовления. RU 2 719 937 C1;
- Массив микроструктур для доставки действующих агентов. RU 2 662 432 C2;
- Микроигольный аппликатор и способ его изготовления. R U 2 652 567 C1;
- Leone M, Mönkäre J, Bouwstra JA, Kersten G. Dissolving Microneedle Patches for Dermal Vaccination. // Pharm Res. 2017 Nov;34(11):2223-2240. doi: 10.1007/s11095-017-2223-2. Epub 2017 Jul 17. PMID: 28718050/
- Waghule et al. Microneedles: A smart approach and increasing potential for transdermal drug delivery system. // 2019 Biomedicine & Pharmacotherapy 109, 1249-1258. doi.org/10.1016/j.biopha.2018.10.078.
- Faraji Rad, Z., Prewett, P.D. & Davies, G.J. High-resolution two-photon polymerization: the most versatile technique for the fabrication of microneedle arrays. // 2021 Microsyst Nanoeng 7, doi.org/10.1038/s41378-021-00298-3.
- Mdanda S, Ubanako P, Kondiah PPD, Kumar P, Choonara YE. Recent Advances in Microneedle Platforms for Transdermal Drug Delivery Technologies. // Polymers (Basel). 2021 Jul 22;13(15):2405. doi: 10.3390/polym13152405. PMID: 34372008.
- Nguyen TT, Nguyen TTD, Tran NM, Vo GV. Advances of microneedles in hormone delivery. // Biomed Pharmacother. 2022 Jan;145:112393. doi: 10.1016/j.biopha.2021.112393. Epub 2021 Nov 10. PMID: 34773762.
- Arshad MS, Zafar S, Zahra AT, Zaman MH, Akhtar A, Kucuk I, Farhan M, Chang MW, Ahmad Z. Fabrication and characterisation of self-applicating heparin sodium microneedle patches. // J Drug Target. 2021 Jan;29(1):60-68. doi: 10.1080/1061186X.2020.1795180. Epub 2020 Jul 27. PMID: 32649227.
- Dillon C, Hughes H, O'Reilly NJ, Allender CJ, Barrow DA, McLoughlin P. Dissolving microneedle based transdermal delivery of therapeutic peptide analogues. // Int J Pharm. 2019 Jun 30;565:9-19. doi: 10.1016/j.ijpharm.2019.04.075. Epub 2019 Apr 29.
PMID: 31047995; - Menon I, Bagwe P, Gomes KB, Bajaj L, Gala R, Uddin MN, D'Souza MJ, Zughaier SM. Microneedles: A New Generation Vaccine Delivery System. // Micromachines (Basel). 2021 Apr 14;12(4):435. doi: 10.3390/mi12040435. PMID: 33919925.
- Rodgers AM, Cordeiro AS, Donnelly RF. Technology update: dissolvable microneedle patches for vaccine delivery. // Med Devices (Auckl). 2019 Sep 19;12:379-398. doi: 10.2147/MDER.S198220. PMID: 31572025.
- Sullivan SP, Koutsonanos DG, Del Pilar Martin M, Lee JW, Zarnitsyn V, Choi SO, Murthy N, Compans RW, Skountzou I, Prausnitz MR. Dissolving polymer microneedle patches for influenza vaccination. // Nat Med. 2010 Aug;16(😎:915-20. doi: 10.1038/nm.2182. Epub 2010 Jul 18. PMID: 20639891.
- Rouphael NG, Paine M, Mosley R, Henry S, McAllister DV, Kalluri H, Pewin W, Frew PM, Yu T, Thornburg NJ, Kabbani S, Lai L, Vassilieva EV, Skountzou I, Compans RW, Mulligan MJ, Prausnitz MR; TIV-MNP 2015 Study Group. The safety, immunogenicity, and acceptability of inactivated influenza vaccine delivered by microneedle patch (TIV-MNP 2015): a randomised, partly blinded, placebo-controlled, phase 1 trial. // Lancet. 2017 Aug 12;390(10095):649-658. doi: 10.1016/S0140-6736(17)30575-5. Epub 2017 Jun 27. PMID: 28666680.
- Kolluru C, Gomaa Y, Prausnitz MR. Development of a thermostable microneedle patch for polio vaccination. // Drug Deliv Transl Res. 2019 Feb;9(1):192-203. doi: 10.1007/s13346-018-00608-9. PMID: 30542944.
- Thomas J. Ellison, George C. Talbott, Daniel R. Henderson. VaxiPatch TM, a novel vaccination system comprised of subunit antigens, adjuvants and microneedle skin delivery: An application to influenza B/Colorado/06/2017. // 2020 Vaccine 38 6839-6848. doi.org/10.1016/j.vaccine.2020.07.040.
- T.Nguyen et al. Progress in microneedle array patch (MAP) for vaccine delivery. // 2021 Human Vaccines & Immunotherapeutics, 17(1), 316 - 327.
- Lee SJ, Lee HS, Hwang YH, Kim JJ, Kang KY, Kim SJ, Kim HK, Kim JD, Jeong DH, Paik MJ, Yee ST. Enhanced anti-tumor immunotherapy by dissolving microneedle patch loaded ovalbumin. PLoS One. 2019 Aug 6;14(😎:e0220382.
doi: 10.1371/journal.pone.0220382. PMID: 31386690. - Kim YC, Lee JW, Esser ES, Kalluri H, Joyce JC, Compans RW, Skountzou I, Prausnitz MR. Fabrication of microneedle patches with lyophilized influenza vaccine suspended in organic solvent. Drug Deliv Transl Res. 2021 Apr;11(2):692-701. doi: 10.1007/s13346-021-00927-4. Epub 2021 Feb 15. PMID: 33590465.
- Joyce JC, Collins ML, Rota PA, Prausnitz MR. Thermostability of Measles and Rubella Vaccines in a Microneedle Patch. Adv Ther (Weinh). 2021 Oct;4(10):2100095. doi: 10.1002/adtp.202100095. Epub 2021 Jul 28. PMID: 34926791.
- Mazzara JM, Ochyl LJ, Hong JKY, Moon JJ, Prausnitz MR, Schwendeman SP. Self-healing encapsulation and controlled release of vaccine antigens from PLGA microparticles delivered by microneedle patches. Bioeng Transl Med. 2018 Oct 30;4(1):116-128. doi: 10.1002/btm2.10103. PMID: 30680323.
- Ingrole RSJ, Azizoglu E, Dul M, Birchall JC, Gill HS, Prausnitz MR. Trends of microneedle technology in the scientific literature, patents, clinical trials and internet activity. Biomaterials. 2021 Jan;267:120491. doi: 10.1016/j.biomaterials.2020.120491. Epub 2020 Nov 5. PMID: 33217629.
- Zheng Z, Diaz-Arévalo D, Guan H, Zeng M. Noninvasive vaccination against infectious diseases. Hum Vaccin Immunother. 2018 Jul 3;14(7):1717-1733. doi: 10.1080/21645515.2018.1461296. Epub 2018 May 17. PMID: 29624470.